题目内容
18. 如图,通过实验来研究冶铁的化学原理:
如图,通过实验来研究冶铁的化学原理:(1)实验结束时:
要继续通入一氧化碳,到玻璃管冷却.这是为了防止生成的铁重新被氧化.
(2)实验过程中玻璃管内观察到的现象是红色粉末变黑,通过实验可以得出一氧化碳的相关化学性质是还原性.
(3)此实验装置不足之处未进行尾气处理.
分析 根据已有的一氧化碳还原氧化铁的知识进行分析解答,一氧化碳能将氧化铁还原为铁,生成的铁是黑色的,一氧化碳是有毒的气体,需要进行尾气处理,据此解答.
解答 解:(1)实验结束时要继续通入一氧化碳直至玻璃管冷却,防止生成的铁重新被氧气氧化,故填:通入一氧化碳,防止生成的铁重新被氧化;
(2)氧化铁是红色的粉末,铁是黑色的粉末,一氧化碳还原氧化铁生成铁和二氧化碳,说明一氧化碳具有还原性,故填:红色粉末变黑,还原性;
(3)一氧化碳是有毒的气体,排放到空气中会造成污染,而本实验没有进行尾气处理,故填:未进行尾气处理.
点评 本题考查的是一氧化碳还原氧化铁的实验,完成此题,可以依据已有的知识进行.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.下列各组微粒结构示意图中,与表示的意义一致的是( )
| A. | 属于同一种元素: | B. | 属于同种原子: | ||
| C. | 都属于阳离子: | D. | 都属于阴离子: |
9.将N2、CO、CO2的混合气体先通过足量澄清的石灰水、再通过足量灼热的氧化铜,最后剩余气体是( )
| A. | N2 | B. | CO2 和N2 | C. | CO2 | D. | CO |
6.根据实践经验,你认为下列课外实验不能成功的是( )
| A. | 用灼烧法鉴别羊毛和化纤 | B. | 用食盐水制作叶脉书签 | ||
| C. | 用回火后的钢针制作鱼钩 | D. | 用紫甘蓝和酒精溶液制酸碱指示剂 |
13.某课外兴趣小组用没有洗净的鸡蛋壳按下表所示步骤进行实验,请在相应空格内填写相关内容.
某同学认为上述实验与结论之间的逻辑关系还不十分严密,为更好地说明问题,依据所学化学知识进行推理,需要补做的实验是:将没有灼烧过的鸡蛋壳研细后放入水中,然后滴入酚酞.
| 实验步骤 | 能观察到的明显现象 | 原因或解释(有化学方程式的就只要写化学方程式) |
| 1.将一小块该鸡蛋壳在酒精喷灯(提供高温)上灼烧 | 有烧焦羽毛的味道 | |
| 2.将灼烧后的鸡蛋壳冷却后研细,投入盛有30mL水的烧杯中,滴入2~3滴酚酞试液 | 溶液变成红色 | |
| 3.继续向烧杯中不断滴加过量的稀盐酸 |
10.实验室里常用双氧水和二氧化锰制取氧气,在该反应中,二氧化锰的作用是( )
| A. | 反应物 | B. | 催化剂 | C. | 反应物和催化剂 | D. | 生成物 |
7.过氧化钠(Na2O2)可用作潜水艇有呼吸面具的供氧剂.实验室有一瓶放置较长时间的过氧化钠样品,某化学研究小组对其成分和性质进行了如下探究.
【查阅资料】过氧化钠能与空气中的水或二氧化碳反应生成氧气.
2Na2O2+2H2O=4NaOH+O2↑;2Na2O2+2CO2=2Na2CO3+O2
【提出问题】这瓶过氧化钠是否变质?
【猜想与假设】
假设1:过氧化钠未变质;
假设2:过氧化钠部分变质;
假设3:你还能提出的假设是过氧化钠全部变质;
【实验探究1】请你设计实验方案验证上面的猜想.
【提出新问题】部分变质的过氧化钠中是否含有氢氧化钠?
【实验探究2】小东取部分固体于试管中,加入适量水溶解,然后再加入足量的氧化钙溶液,有白色沉淀生成,静置,向上层清液中滴加2滴无色酚酞试液,游溶液变红则说明变质的过氧化钠中含有氢氧化风钠.
【定性分析】
(1)由【实验探究2]可以确定在加入氯化钙溶液前,溶液中含有的溶质是NaOH、Na2CO3(填化学式).
(2)小明认为,由上述实验无法确定原固体样品中是否含有氢氧化钠,理由是过氧化钠和水反应也能生成氢氧化钠.
【定量研究】称取6.04g的过氧化钠样品于锥形瓶中,加入足量的蒸馏水,共收集到气体0.64g,再向上述锥形瓶中加入足量的澄清石灰水,充分反应后,经过沉淀、过滤、干燥等,得到固体2.00g.
(1)写出加入石灰水后的化学反应方程式Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
(2)6.04g上述样品中,含有氢氧化钠的质量是0.8g.
【反思与提高】过氧化钠长期暴露在空气中,最终会变质为Na2CO3(填化学式).
【查阅资料】过氧化钠能与空气中的水或二氧化碳反应生成氧气.
2Na2O2+2H2O=4NaOH+O2↑;2Na2O2+2CO2=2Na2CO3+O2
【提出问题】这瓶过氧化钠是否变质?
【猜想与假设】
假设1:过氧化钠未变质;
假设2:过氧化钠部分变质;
假设3:你还能提出的假设是过氧化钠全部变质;
【实验探究1】请你设计实验方案验证上面的猜想.
| 序号 | 实验步骤 | 实验现象 | 实验结论 |
| (1) | 假设1成立 | ||
| (2) | 假设2成立 | ||
| (3) | 假设3成立 |
【实验探究2】小东取部分固体于试管中,加入适量水溶解,然后再加入足量的氧化钙溶液,有白色沉淀生成,静置,向上层清液中滴加2滴无色酚酞试液,游溶液变红则说明变质的过氧化钠中含有氢氧化风钠.
【定性分析】
(1)由【实验探究2]可以确定在加入氯化钙溶液前,溶液中含有的溶质是NaOH、Na2CO3(填化学式).
(2)小明认为,由上述实验无法确定原固体样品中是否含有氢氧化钠,理由是过氧化钠和水反应也能生成氢氧化钠.
【定量研究】称取6.04g的过氧化钠样品于锥形瓶中,加入足量的蒸馏水,共收集到气体0.64g,再向上述锥形瓶中加入足量的澄清石灰水,充分反应后,经过沉淀、过滤、干燥等,得到固体2.00g.
(1)写出加入石灰水后的化学反应方程式Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
(2)6.04g上述样品中,含有氢氧化钠的质量是0.8g.
【反思与提高】过氧化钠长期暴露在空气中,最终会变质为Na2CO3(填化学式).

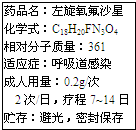 新药左旋氧氟沙星(C18H20FN3O4)可用于治疗敏感菌引起的呼吸道感染,其说明书中部分内容如图.
新药左旋氧氟沙星(C18H20FN3O4)可用于治疗敏感菌引起的呼吸道感染,其说明书中部分内容如图.