题目内容
14.用CO和H2在443K~473K温度下,并用钴(Co)作催化剂时,可以反应生成n=5~8的烷烃,这是人工合成汽油的方法之一.(1)写出用CnH2n+2表示的人工合成汽油的配平的化学方程式nCO+(2n+1)H2$\stackrel{Co}{→}$CnH2n+2+nH2O.
(2)要达到上述合成汽油的要求,CO和H2的体积比的取值范围是$\frac{5}{11}∽\frac{8}{17}$.
分析 根据一氧化碳和氢气在钴作催化剂的条件下反应生成汽油和水进行分析解答,根据达到汽油的要求,碳原子的个数为5~8进行分析解答即可.
解答 解:(1)根据题干提供的信息可以知道,反应后生成的是CnH2n+2和水,故反应的化学方程式为:nCO+(2n+1)H2$\stackrel{Co}{→}$CnH2n+2+nH2O;
(2)根据反应的化学方程式可以看出,一氧化碳和氢气的体积比为:$\frac{n}{2n+1}$,若n=5,则是$\frac{5}{11}$,若n是8,则是$\frac{8}{17}$,故其体积比的范围是$\frac{5}{11}∽\frac{8}{17}$,故填:$\frac{5}{11}∽\frac{8}{17}$.
点评 本题考查的是物质制备的知识,完成此题,可以依据题干提供的信息进行.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
10.某同学加热氯酸钾与二氧化锰的混合物16.5g制取氧气,加热过程中测得试管内剩余固体物质的质量随时间变化如表所示:
请计算:
(1)该同学制得氧气的质量为多少?
(2)加热到5min时剩余固体中氯化钾的质量为多少?
| 反应时间/min | 1 | 2 | 3 | 4 | 5 | 6 |
| 剩余固体物质的质量/g | 15.9 | 14.6 | 12.2 | 11.7 | 11.7 | 11.7 |
(1)该同学制得氧气的质量为多少?
(2)加热到5min时剩余固体中氯化钾的质量为多少?
2.化学小组的同学探究二氧化碳和氢氧化钠的反应,实验方案如下:•
(1)步骤①中气球鼓起的原因可能是NaOH溶液吸收了CO2,导致瓶内压强减小.
(2)步骤②中的操作是向外拉注射器3,其目的是证明步骤1中将瓶内的CO2全部吸收了.
(3)步骤①中发生反应的化学方程式为2NaOH+CO2═Na2CO3+H2O.
(4)本实验的结论是CO2能和NaOH发生反应.
| 实验装置 | 实验步骤及操作 | 实验现象 |
 | ①将注射器1中的溶液推入充有CO2的瓶中 | 气球鼓起 |
| ②向外拉注射器3 | 无明显现象 | |
| ③将注射器2中的溶液推入瓶中 | 溶液中有气泡产生,气球变瘪 | |
| ④向外拉注射器3 | 澄清石灰水变浑浊 |
(2)步骤②中的操作是向外拉注射器3,其目的是证明步骤1中将瓶内的CO2全部吸收了.
(3)步骤①中发生反应的化学方程式为2NaOH+CO2═Na2CO3+H2O.
(4)本实验的结论是CO2能和NaOH发生反应.
9.某同学在实验室进行有关浓硫酸的实验,观察瓶上的标签(如右表所示).他从瓶中倒出100毫升用于配制成稀硫酸,问
(1)这100毫升浓硫酸的质量为184克,其中含溶质硫酸180.32克.
(2)欲配制100毫升质量分数为20%的稀硫酸(密度为1.14克每立方厘米),需要多少毫升这种浓硫酸和多少毫升水?
| 浓硫酸(H2SO4)500毫升 | |
| 浓度(质量分数) | 98% |
| 密度 | 1.84克/厘米3 |
| 相对分子质量 | 98 |
| 强腐蚀性,阴冷,密封贮藏 | |
(2)欲配制100毫升质量分数为20%的稀硫酸(密度为1.14克每立方厘米),需要多少毫升这种浓硫酸和多少毫升水?
6.用如图所示装置(图中夹持仪器已略去)测定某牙膏样品中碳酸钙的质量分数.实验中,通过测定丙装置质量的改变值,就能达到目的(样品中其他成分遇盐酸不产生气体).下列措施能提高测定准确度的是( ) 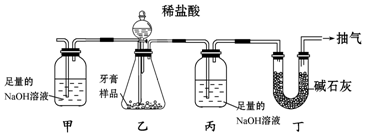

| A. | 省去装置甲和丁 | |
| B. | 将丙中的NaOH溶液换成Ca(OH)2溶液 | |
| C. | 滴加稀盐酸之前,先抽气一段时间,除去装置内原有的CO2 | |
| D. | 装置乙不再产生气泡时,立即停止抽气 |
4.给试管中的液体加热时,若出现试管破裂的现象,其原因不可能是( )
| A. | 加热前试管外壁有水 | B. | 加热不均匀,局部温度过高 | ||
| C. | 试管内的液体超过 $\frac{1}{3}$ | D. | 试管触及灯芯了 |

