题目内容
3.某粗盐样品中含有钙、镁的氯化物和硫酸钠等杂质,以下是提纯该样品的流程图.
请回答:
(1)“操作②”中,需要用到的玻璃仪器有烧杯、玻璃棒、漏斗;“试剂A”的化学式为Ba(OH)2.
(2)判断所加“试剂A”是否过量的具体操作是滴入酚酞溶液.
(3)加入NaOH溶液的目的是充分除去滤液中的镁离子,反应的化学方程式为MgCl2+2NaOH═Mg(OH)2↓+2NaCl.
(4)“沉淀a”的组成是BaCO3、CaCO3、MgCO3、Mg(OH)2(填化学式).
(5)“操作⑤”中要使用玻璃棒,其作用是搅拌,防止局部过热造成液滴飞溅.
分析 根据硫酸根用钡离子除掉,镁离子用氢氧根离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子进行分析;考虑氢氧化钠和氯化镁会生成氢氧化镁沉淀,进行书写.
解答 解:因为硫酸根用钡离子除掉,镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀;钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,故除掉少量的CaCl2和MgCl2以及不溶性杂质,根据流程图,可知:
(1)“操作②”中,需要用到的玻璃仪器有烧杯、玻璃棒、漏斗;“试剂A”为氢氧化钡溶液,其化学式为Ba(OH)2.
(2)因为氢氧化钡为碱溶液,故判断所加“试剂A”是否过量的具体操作是滴入酚酞溶液,如果溶液变红,则氢氧化钡过量.
(3)加入NaOH溶液的目的是充分除去滤液中的镁离子,则氢氧化钠溶液与氯化镁溶液反应生成氯化钠和氢氧化镁沉淀,其反应方程式为:MgCl2+2NaOH═Mg(OH)2↓+2NaCl.
(4)因为滤液a中含有氯化钙、氯化镁、氢氧化钡,氢氧化钠,它们与过量的氢氧化钠、碳酸钠反应,故“沉淀a”的组成是碳酸钡、碳酸钙、碳酸镁,氢氧化镁,其化学式分别为:BaCO3、CaCO3、MgCO3、Mg(OH)2;
(5)“操作⑤”为蒸发,故玻璃棒的作用是搅拌,防止局部过热造成液滴飞溅.
故答案为:
(1)漏斗;Ba(OH)2.(2)滴入酚酞溶液.
(3)充分除去滤液中的镁离子,MgCl2+2NaOH═Mg(OH)2↓+2NaCl.
(4)BaCO3、CaCO3、MgCO3、Mg(OH)2.
(5)搅拌,防止局部过热造成液滴飞溅.
点评 本题主要考查选择试剂、化学方程式的写法及蒸发操作,完成此题,可以依据物质的性质进行.

| A. | 扩大公共绿地,打造绿色家园 | B. | 禁止秸杆焚烧,减轻雾霾影响 | ||
| C. | 发展公共交通,提倡低碳生活 | D. | 鼓励燃煤发电,保障电力供应 |
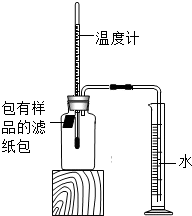 小明对铁的锈蚀进行如下探究,室温时,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,装置如图,观察到量筒内水沿导管慢慢进入广口瓶(净容积为146mL).当温度恢复至室温,且量筒内水面高度不变时读数(此时瓶内氧气含量近似为零).记录起始和最终量筒的读数以及所需时间如表.
小明对铁的锈蚀进行如下探究,室温时,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,装置如图,观察到量筒内水沿导管慢慢进入广口瓶(净容积为146mL).当温度恢复至室温,且量筒内水面高度不变时读数(此时瓶内氧气含量近似为零).记录起始和最终量筒的读数以及所需时间如表.| 序号 | 样品 | 量筒起始 读数/mL | 量筒最终 读数/mL | 所需时间 /min |
| 1 | 1g铁粉、0.2g碳和10滴水 | 100 | 70 | 约120 |
| 2 | lg铁粉、0.2g碳、10滴水和少量NaCl | 100 | 70 | 约70 |
| 3 | 1g铁粉、10滴水 | 100 | 70 | 约480 |
(2)实验开始后,广口瓶内温度有所上升,说明铁的锈蚀过程是放热 (填“放热”或“吸热”)过程.
(3)实验结束后取出滤纸包,观察到有红棕色物质生成,该物质的化学式是Fe2O3•xH2O.
(4)已知含碳能够加快铁的生锈速度,小明想通过实验①和③是探究碳对铁锈蚀速率的影响,请在表格空白处填写实验③的样品组成.
(5)该装置还可用于测量空气中氧气的含量,根据上述数据计算氧气的体积含量是20.5%(小数点后保留1位).
| A. | 硬度较小 | B. | 密度较大 | C. | 导电性好 | D. | 化学性质稳定 |


 如图是常见固体物质的溶解度曲线,根据图示回答:
如图是常见固体物质的溶解度曲线,根据图示回答: