题目内容
 某化学兴趣小组对“锌与硫酸反应快慢的影响因素”进行了探究.
某化学兴趣小组对“锌与硫酸反应快慢的影响因素”进行了探究.【提出问题】锌与硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】a.可能与硫酸的质量分数有关;b.可能与锌的形状有关.
【设计并实验】用不同质量分数的稀硫酸和不同形状的锌进行如表实验.
| 实验编号 | 硫酸的质量分数 (均取20mL) | 锌的形状 (均取1g) | 氢气的体积(mL) (均收集3分钟) |
| ① | 20% | 锌粒 | 31.7 |
| ② | 20% | 锌粉 | 50.9 |
| ③ | 30% | 锌粒 | 61.7 |
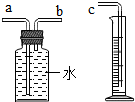
(2)用如图装置收集并测量氢气的体积,其中量筒的作用是
(3)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是
(4)分析上述实验得出的结论是:①锌粉比锌粒的反应速率快,②
(5)如表是第①组实验的详细数据.
| 时段(均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
| H2的体积 | 3.1mL | 16.7mL | 11.9mL | 9.6mL | 7.6mL | 6.0mL |
考点:影响化学反应速率的因素探究,量气装置,氢气的制取和检验,书写化学方程式、文字表达式、电离方程式
专题:科学探究
分析:(1)根据锌和硫酸反应产生硫酸锌和氢气,写出反应的方程式;
(2)为测定所收集氢气的体积,则需要采用液体等量代换的方式,因此可以选用右图这样的装置,短进长出,让里面的水等量流到量筒内,通过量筒内液体的体积判断收集的气体的体积;
(3)对比四个实验,利用控制变量法选择合适的对比组;
(4)通过不同质量分数的硫酸与锌反应产生氢气的快慢得出结论;
(5)根据金属表面有氧化膜分析原因.
(2)为测定所收集氢气的体积,则需要采用液体等量代换的方式,因此可以选用右图这样的装置,短进长出,让里面的水等量流到量筒内,通过量筒内液体的体积判断收集的气体的体积;
(3)对比四个实验,利用控制变量法选择合适的对比组;
(4)通过不同质量分数的硫酸与锌反应产生氢气的快慢得出结论;
(5)根据金属表面有氧化膜分析原因.
解答:解:(1)锌和硫酸反应产生硫酸锌和氢气,故反应的方程式为:Zn+H2SO4=ZnSO4+H2↑;
(2)因为氢气不易溶于水,可以通过压强的变化利用排水法把水压入量筒内,根据进入量筒中水的体积,判断生成氢气的体积,故进气管是短管b,水从a排进量筒;
(3)要比较不同质量分数的硫酸对反应快慢的影响,其中的锌的状态保持不变,选择不同质量分数的硫酸,看产生氢气的快慢,因此可以选择①③(都是锌粒);
(4)通过①③(都是锌粒,硫酸的质量分数不同),可以看出:硫酸的质量分数越大,反应速率越快;
(5)由于金属表面有氧化物,反应开始时,硫酸与金属表面的氧化物先反应,等氧化物反应完,反应开始变快,因此开始时由慢变快;
故答案为:(1)Zn+H2SO4=ZnSO4+H2↑; (2)根据进入量筒中水的体积,判断生成氢气的体积;b;
(3)①③;(4)硫酸的质量分数越大,反应速率越快;(5)反应开始时,硫酸与金属表面的氧化物先反应.
(2)因为氢气不易溶于水,可以通过压强的变化利用排水法把水压入量筒内,根据进入量筒中水的体积,判断生成氢气的体积,故进气管是短管b,水从a排进量筒;
(3)要比较不同质量分数的硫酸对反应快慢的影响,其中的锌的状态保持不变,选择不同质量分数的硫酸,看产生氢气的快慢,因此可以选择①③(都是锌粒);
(4)通过①③(都是锌粒,硫酸的质量分数不同),可以看出:硫酸的质量分数越大,反应速率越快;
(5)由于金属表面有氧化物,反应开始时,硫酸与金属表面的氧化物先反应,等氧化物反应完,反应开始变快,因此开始时由慢变快;
故答案为:(1)Zn+H2SO4=ZnSO4+H2↑; (2)根据进入量筒中水的体积,判断生成氢气的体积;b;
(3)①③;(4)硫酸的质量分数越大,反应速率越快;(5)反应开始时,硫酸与金属表面的氧化物先反应.
点评:本题以影响产生氢气的反应速率为实验探究的形式考查了反应物浓度、颗粒的大小、反应温度等因素对化学反应速率的影响,重点在于培养学生的实验探究能力,注意控制变量的运用.

练习册系列答案
相关题目
下列物质的化学式书写错误的是( )
| A、氯化钠 NaCl |
| B、氧化铝 AlO |
| C、氢氧化铁 Fe(OH)3 |
| D、硫酸铜 CuSO4 |
在pH=13的溶液中,大量存在的离子组不可能是( )
| A、Na+ NO3- K+ Ba2+ |
| B、Cl- Ba2+ Ca2+ NH4+ |
| C、SO42- Cl- K+ Na+ |
| D、Na+ K+ CO32- Cl- |
 不少同学都被蚊虫叮咬过,感觉又痛又痒.同学们从化学课上知道:蚊虫叮咬时能在人的皮肤内释放出蚁酸刺激皮肤,课外兴趣小组同学决定对蚁酸进行探究.
不少同学都被蚊虫叮咬过,感觉又痛又痒.同学们从化学课上知道:蚊虫叮咬时能在人的皮肤内释放出蚁酸刺激皮肤,课外兴趣小组同学决定对蚁酸进行探究. 构建知识网络是一种重要的学习方法,如图是关于E物质的知识网络,E物质是海洋中最多的一种物质,C物质的组成元素与E完全相同,D物质存在于汽水中,B物质是一种单质,具有助燃性;A物质组成元素中含有金属元素(注意:反应条件、部分反应物和生成物没有给出).
构建知识网络是一种重要的学习方法,如图是关于E物质的知识网络,E物质是海洋中最多的一种物质,C物质的组成元素与E完全相同,D物质存在于汽水中,B物质是一种单质,具有助燃性;A物质组成元素中含有金属元素(注意:反应条件、部分反应物和生成物没有给出).