题目内容
某校实验室的废液缸中收集了同学们在实验室用石灰石与稀盐酸制取CO2后残留的废液(假设石灰石中的其它杂质不与盐酸反应也不溶于水).小红、小刚和小明想探究废液中溶质的成分,请你一同参与探究并回答下列问题.
Ⅰ.定性探究
【提出问题】废液中的溶质是什么物质?
【作出猜想】小红认为废液中溶质只有CaCl2;小刚认为废液中溶质是CaCl2和CaCO3;
小明认为废液中溶质是 (填化学式).
【查阅资料】CaCl2溶液呈中性.
【实验与结论】小红认为小刚的猜想是错误的,理由是: .她从废液缸中取少许上层清液(下称“废液”),滴入1-2滴无色酚酞试液,酚酞试液不变色,于是小红认为她的猜想正确,你认为她的观点 (填“正确”或“不正确”).
小明也取少许废液,向其中加入少量的氧化铜粉末,充分反应,看到的现象是 ,化学反应方程式是 ,结论:小明的猜想是正确的.
【交流与讨论】(1)小明又取少许废液,向其中逐滴滴加碳酸钠溶液,并不断振荡,反应现象是
A.只看到有大量气泡冒出 B.只有白色沉淀析出
C.开始出现白色沉淀,后冒气泡 D.开始冒气泡,后出现白色沉淀
(2)若记录滴入Na2CO3溶液质量(x)与有关量的变化关系 (y)如图1所示.图中纵坐标(y)表示 (填“生成气体的质量”或“生成沉淀的质量”).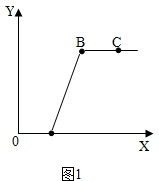
OA段发生反应的化学方程式是: ;
AB段发生反应的化学方程式是: ;
部分物质的溶解性表
(3)小刚也取少许废液,向其中滴加过量的NaOH溶液,发现有少量白色的沉淀产生,他认为所用NaOH溶液可能变质,该白色沉淀是CaCO3;根据上述物质的溶解性表,你认为该白色沉淀还可能是 .
Ⅱ.定量探究
为了分析废液里HCl和CaCl2的质量分数,设计了如图2的实验方案: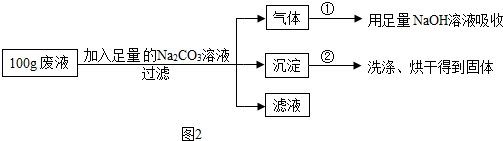
【实验数据】实验共记录了两组数据:
第①组,气体吸收完全后,NaOH溶液质量增加0.44g (不考虑挥发出来的氯化氢和水蒸气对实验的影响);第②组,沉淀完全后,经过滤、洗涤、烘干后得到固体的质量为20g.
根据实验设计及有关数据进行分析与计算:
(1)废液中HCl的质量分数为 .(只写结果)
(2)废液中CaCl2的质量分数为多少?(写出计算过程,本小题3分)
【交流与反思】若要想使废液只有CaCl2溶液,应向废液中加入过量的 ,反应完成后过滤即可.
Ⅰ.定性探究
【提出问题】废液中的溶质是什么物质?
【作出猜想】小红认为废液中溶质只有CaCl2;小刚认为废液中溶质是CaCl2和CaCO3;
小明认为废液中溶质是
【查阅资料】CaCl2溶液呈中性.
【实验与结论】小红认为小刚的猜想是错误的,理由是:
小明也取少许废液,向其中加入少量的氧化铜粉末,充分反应,看到的现象是
【交流与讨论】(1)小明又取少许废液,向其中逐滴滴加碳酸钠溶液,并不断振荡,反应现象是
A.只看到有大量气泡冒出 B.只有白色沉淀析出
C.开始出现白色沉淀,后冒气泡 D.开始冒气泡,后出现白色沉淀
(2)若记录滴入Na2CO3溶液质量(x)与有关量的变化关系 (y)如图1所示.图中纵坐标(y)表示

OA段发生反应的化学方程式是:
AB段发生反应的化学方程式是:
部分物质的溶解性表
| 离子 | OH- | CO32- | Cl- |
| Na+ | 易溶 | 易溶 | 易溶 |
| Ca2+ | 微溶 | 不溶 | 易溶 |
Ⅱ.定量探究
为了分析废液里HCl和CaCl2的质量分数,设计了如图2的实验方案:

【实验数据】实验共记录了两组数据:
第①组,气体吸收完全后,NaOH溶液质量增加0.44g (不考虑挥发出来的氯化氢和水蒸气对实验的影响);第②组,沉淀完全后,经过滤、洗涤、烘干后得到固体的质量为20g.
根据实验设计及有关数据进行分析与计算:
(1)废液中HCl的质量分数为
(2)废液中CaCl2的质量分数为多少?(写出计算过程,本小题3分)
【交流与反思】若要想使废液只有CaCl2溶液,应向废液中加入过量的
考点:实验探究物质的组成成分以及含量,二氧化碳的实验室制法,有关溶质质量分数的简单计算,盐的化学性质,根据化学反应方程式的计算
专题:科学探究
分析:【作出猜想】盐酸可能会剩余.
【实验与结论】考虑碳酸钙的性质;根据酸和碱遇到指示剂的颜色变化即可.
根据结论:小明的猜想是正确的.推测稀盐酸与氧化铜的反应现象和化学方程式;
【交流与讨论】
(1)考虑稀盐酸与碳酸钠溶液,并不断振荡,反应现象;
(2)根据记录滴入Na2CO3溶液质量(x)与有关量的变化关系 (y)如图1所示.推测图中纵坐标(y)表示的意义.如图1所示,考虑OA段考虑稀盐酸与碳酸钠发生反应;AB段考虑氯化钙与碳酸钠发生反应;
(3)根据部分物质的溶解性表,考虑氢氧化钙微溶.
【实验数据】
(1)由题意可以知道生成二氧化碳的质量为4.4g,据此结合碳酸钠和盐酸反应的化学方程式求算出氯化氢的质量,然后求出其质量分数即可;
(2)根据图中数据可以知道生成沉淀的质量为20g,据此结合碳酸钠和氯化钙反应的化学方程式求算出氯化钙的质量,然后求出其质量分数即可.
【交流与反思】
根据除杂的条件和题目信息(最后过滤)即可.
【实验与结论】考虑碳酸钙的性质;根据酸和碱遇到指示剂的颜色变化即可.
根据结论:小明的猜想是正确的.推测稀盐酸与氧化铜的反应现象和化学方程式;
【交流与讨论】
(1)考虑稀盐酸与碳酸钠溶液,并不断振荡,反应现象;
(2)根据记录滴入Na2CO3溶液质量(x)与有关量的变化关系 (y)如图1所示.推测图中纵坐标(y)表示的意义.如图1所示,考虑OA段考虑稀盐酸与碳酸钠发生反应;AB段考虑氯化钙与碳酸钠发生反应;
(3)根据部分物质的溶解性表,考虑氢氧化钙微溶.
【实验数据】
(1)由题意可以知道生成二氧化碳的质量为4.4g,据此结合碳酸钠和盐酸反应的化学方程式求算出氯化氢的质量,然后求出其质量分数即可;
(2)根据图中数据可以知道生成沉淀的质量为20g,据此结合碳酸钠和氯化钙反应的化学方程式求算出氯化钙的质量,然后求出其质量分数即可.
【交流与反思】
根据除杂的条件和题目信息(最后过滤)即可.
解答:解:
【作出猜想】实验室用石灰石和稀盐酸制取CO2,反应后,盐酸可能有剩余,故答案为:HCl.
【实验与结论】小红认为小刚的猜想是错误的,理由是:CaCO3不溶于水.根据酸和碱遇到指示剂的颜色变化:CaCl2是中性,HCl是酸性,中性物质和酸性物质都不能使酚酞颜色发生变化,故答案为:不能,酚酞遇酸也不变色(其它答案合理均可).
小明也取少许废液,向其中加入少量的氧化铜粉末,则稀盐酸与氧化铜充分反应,看到的现象是溶液变成蓝色,化学反应方程式是 CuO+2HCl=CuCl2+H2O,结论:小明认为废液中溶质是 CaCl2、HCl,其猜想正确.
【交流与讨论】(1)因为“小明认为废液中溶质是 CaCl2、HCl”,则小明又取少许废液,向其中逐滴滴加碳酸钠溶液,并不断振荡,反应现象是:开始冒气泡,后出现白色沉淀.故选:D.
(2)若记录滴入Na2CO3溶液质量(x)与有关量的变化关系 (y)如图1所示.图中纵坐标(y)表示 生成沉淀的质量.OA段考虑稀盐酸与碳酸钠发生反应,则其发生反应的化学方程式是:Na2CO3+2HCl=2NaCl+H2O+CO2↑;
AB段考虑氯化钙与碳酸钠发生反应,则其发生反应的化学方程式是:CaCl2+Na2CO3=CaCO3↓+2NaCl;
(3)根据部分物质的溶解性表,考虑氢氧化钙微溶.则该白色沉淀还可能是 Ca(OH)2.
【实验数据】
(1)氢氧化钠溶液增加的质量即为碳酸钠和盐酸反应生成二氧化碳的质量,即为4.4g,
设混合溶液中含有氯化氢的质量为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
73 44
x 4.4g
则
=
,解得x=7.3g
故混合溶液中HCl的质量分数为:
×100%=7.3%;
(2)设混合溶液中CaCl2的质量为y.
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 100
y 20g
则
=
,解得y=22.2g
故混合溶液中CaCl2的质量分数为:
×100%=22.2%;
答:混合溶液中CaCl2的质量分数为22.2%.
【交流与反思】根据除杂的条件可知,碳酸钙和氯化钙不会反应,碳酸钙和盐酸生成氯化钙和水和二氧化碳气体,因此加入碳酸钙可以除去盐酸,故答案为:碳酸钙.
故答案为:
Ⅰ.定性探究【作出猜想】CaCl2、HCl;【实验与结论】CaCO3不溶于水;不正确
溶液变成蓝色; CuO+2HCl=CuCl2+H2O;
【交流与讨论】
(1)D; (2)生成沉淀的质量; Na2CO3+2HCl=2NaCl+H2O+CO2↑
CaCl2+Na2CO3=CaCO3↓+2NaCl;(3)Ca(OH)2
Ⅱ.定量探究【实验数据】(1)0.73%; (2)22.2%
【交流与反思】CaCO3(或石灰石)
【作出猜想】实验室用石灰石和稀盐酸制取CO2,反应后,盐酸可能有剩余,故答案为:HCl.
【实验与结论】小红认为小刚的猜想是错误的,理由是:CaCO3不溶于水.根据酸和碱遇到指示剂的颜色变化:CaCl2是中性,HCl是酸性,中性物质和酸性物质都不能使酚酞颜色发生变化,故答案为:不能,酚酞遇酸也不变色(其它答案合理均可).
小明也取少许废液,向其中加入少量的氧化铜粉末,则稀盐酸与氧化铜充分反应,看到的现象是溶液变成蓝色,化学反应方程式是 CuO+2HCl=CuCl2+H2O,结论:小明认为废液中溶质是 CaCl2、HCl,其猜想正确.
【交流与讨论】(1)因为“小明认为废液中溶质是 CaCl2、HCl”,则小明又取少许废液,向其中逐滴滴加碳酸钠溶液,并不断振荡,反应现象是:开始冒气泡,后出现白色沉淀.故选:D.
(2)若记录滴入Na2CO3溶液质量(x)与有关量的变化关系 (y)如图1所示.图中纵坐标(y)表示 生成沉淀的质量.OA段考虑稀盐酸与碳酸钠发生反应,则其发生反应的化学方程式是:Na2CO3+2HCl=2NaCl+H2O+CO2↑;
AB段考虑氯化钙与碳酸钠发生反应,则其发生反应的化学方程式是:CaCl2+Na2CO3=CaCO3↓+2NaCl;
(3)根据部分物质的溶解性表,考虑氢氧化钙微溶.则该白色沉淀还可能是 Ca(OH)2.
【实验数据】
(1)氢氧化钠溶液增加的质量即为碳酸钠和盐酸反应生成二氧化碳的质量,即为4.4g,
设混合溶液中含有氯化氢的质量为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
73 44
x 4.4g
则
| 73 |
| x |
| 44 |
| 4.4g |
故混合溶液中HCl的质量分数为:
| 7.3g |
| 100g |
(2)设混合溶液中CaCl2的质量为y.
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 100
y 20g
则
| 111 |
| y |
| 100 |
| 20g |
故混合溶液中CaCl2的质量分数为:
| 22.2g |
| 100g |
答:混合溶液中CaCl2的质量分数为22.2%.
【交流与反思】根据除杂的条件可知,碳酸钙和氯化钙不会反应,碳酸钙和盐酸生成氯化钙和水和二氧化碳气体,因此加入碳酸钙可以除去盐酸,故答案为:碳酸钙.
故答案为:
Ⅰ.定性探究【作出猜想】CaCl2、HCl;【实验与结论】CaCO3不溶于水;不正确
溶液变成蓝色; CuO+2HCl=CuCl2+H2O;
【交流与讨论】
(1)D; (2)生成沉淀的质量; Na2CO3+2HCl=2NaCl+H2O+CO2↑
CaCl2+Na2CO3=CaCO3↓+2NaCl;(3)Ca(OH)2
Ⅱ.定量探究【实验数据】(1)0.73%; (2)22.2%
【交流与反思】CaCO3(或石灰石)
点评:这个题涉及知识要点较多,掌握发生装置和收集装置的选择条件以及常见气体的实验室制法,掌握除杂的要求和指示剂的颜色变化规律.

练习册系列答案
相关题目
下列物质中,属于纯净物的是( )
A、 加碘盐 |
B、 调和植物油 |
C、 沐浴液 |
D、 干冰 |
向盛有一定质量的NaCl和Na2SO4固体混合物的烧杯中加水,固体完全溶解后,再加入一定质量分数的BaCl2溶液至恰好完全反应,过滤烘干得到23.3g沉淀,经测定滤液中含有氯元素的质量为21.3g(不考虑过程中物质质量的损失),计算原固体混合物中NaCl的质量为( )
| A、5.85g |
| B、11.7g |
| C、14.2g |
| D、23.4g |
有机合成材料的出现是材料发展史上的一次重大突破.下列物品中,不含有机合成材料的是( )
A、 塑胶跑道 |
B、 电源插座 |
C、 电线 |
D、 青铜奔马 |
 现有盐酸和氯化钙的混合溶液,向其中逐滴加入过量的某物质X,溶液PH随滴入X的量的变化关系如图所示,则X是( )
现有盐酸和氯化钙的混合溶液,向其中逐滴加入过量的某物质X,溶液PH随滴入X的量的变化关系如图所示,则X是( )| A、水 | B、氢氧化钡溶液 |
| C、纯碱溶液 | D、烧碱溶液 |
 某化学兴趣小组对“锌与硫酸反应快慢的影响因素”进行了探究.
某化学兴趣小组对“锌与硫酸反应快慢的影响因素”进行了探究.