题目内容
11.甲同学认为Ca(OH)2与CO2反应,而NaOH与CO2不能反应,因为实验室检验CO2用澄清石灰水而不用NaOH溶液.乙同学认为甲同学的说法不完全正确.乙同学想通过实验证明自己的观点.请你与乙同学一起在实验室完成以下实验.
(1)【提出假设】NaOH能与CO2反应.
(2)【设计方案】
①CO2的制取:
a.实验室制取CO 2的化学反应方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑.
b.如图所示装置中,正确的发生装置是C(填字母),不选择其他发生装置的理由是该反应是固体和液体在常温下进行的,故排除A,而B中长颈漏斗未插入液面以下,导管反而插入到了液面以下,操作错误故发生装置选C(答一种).
c.实验开始前必须进行的操作是检查装置的气密性.
②【验证假设】
取一定量的氢氧化钠溶液,向其中通入适量的二氧化碳,为了探究两者是否发生了化学反应,乙同学与同学们经过讨论,提出以下三种实验方案:
方案一:向所得溶液中滴加无色酚酞溶液,溶液变红,说明NaOH未与CO2反应;
方案二:向所得溶液中滴加稀盐酸,有气泡产生,说明NaOH与CO2发生了反应;
方案三:向所得溶液中滴加CaCl2溶液,溶液变浑浊,说明NaOH与CO2发生了反应.
你认为三种方案中,可行的是方案二和方案三,其他方案不可行的理由是碳酸钠溶液也呈碱性,故不能通过无色酚酞变色判断是否发生反应.
(3)【总结反思】实验室里NaOH易变质,因此实验室里的氢氧化钠必须密封保存.
分析 设计方案:明确二氧化碳的制取原理、发生装置的选择和操作步骤分析解答;
验证假设:根据碳酸钠的性质分析判断.
解答 解:设计方案:①二氧化碳的制取:
a、实验室制取二氧化碳的反应原理是碳酸钙和稀盐酸反应生成氯化钙水和二氧化碳,
b、根据反应物的状态和反应条件是固液常温型,故在和C中选,但B装置错误:长颈漏斗未伸入液面下,导气管太长,故不选;
c、实验开始前必须进行的操作是连接好仪器装置检查装置气密性;
验证假设:
方案一、氢氧化钠和二氧化碳反应生成碳酸钠溶于水溶液呈碱性也能使无色酚酞变红色;
方案二、氢氧化钠与二氧化碳反应生成碳酸钠,加盐酸会产生二氧化碳,故可行;
方案三、氢氧化钠与二氧化碳反应生成碳酸钠,加入氯化钙后会产生碳酸钙白色沉淀,故该方案可行;
故答案:①a. CaCO3+2HCl═CaCl2+H2O+CO2↑
b. C;该反应是固体和液体在常温下进行的,故排除A,而B中长颈漏斗未插入液面以下,导管反而插入到了液面以下,操作错误故发生装置选C;
c.检查装置的气密性
②方案二和方案三;碳酸钠溶液也呈碱性,故不能通过无色酚酞变色判断是否发生反应
点评 考查知识面较多,要求分析能力较强,要用耐心,表达准确.

练习册系列答案
相关题目
2.实验设计是化学实验的重要环节,用对比实验方法探究二氧化碳的性质,请根据下列实验要求回答相关问题,
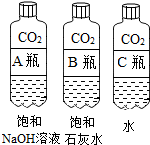
【实验一】振荡3个矿泉水塑料瓶,观察到塑料瓶变瘪的程度为A>B>C,其中变浑浊的瓶内发生反应的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O;对比A瓶与C(填“B”或“C”)瓶的实验现象,可证明CO2能与NaOH发生反应.
【实验二】观察到C装置中发生的现象是干燥的石蕊试纸无变化,湿润的蓝色石蕊试纸变红色,结论是CO2+H2O=H2CO3(用化学方程式表示).
| 实验一 | 实验二 |
 | 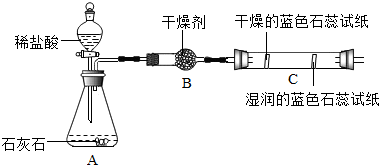 |
【实验二】观察到C装置中发生的现象是干燥的石蕊试纸无变化,湿润的蓝色石蕊试纸变红色,结论是CO2+H2O=H2CO3(用化学方程式表示).
6.下列物质中,属于纯净物的是( )
| A. | 白酒 | B. | 石灰石 | C. | 冰 水混合物 | D. | 不锈钢 |
3.下列物质由分子构成的是( )
| A. | 氯化钠 | B. | 铜 | C. | 晶体硅 | D. | 冰 |
20.甲烷和水反应可以制备水煤气(混合气体),其反应的微观示意图如下所示:根据以上微观示意图得出的结论中,正确的是( )


| A. | 水煤气的成分是一氧化碳和氧气 | |
| B. | 该反应属于置换反应 | |
| C. | 反应前后碳元素的化合价没有发生变化 | |
| D. | 反应中甲和丙的质量之比为4:7 |
1.下列是物品回收标识的是( )
| A. |  | B. |  | C. |  | D. |  |

 在一烧杯中盛有22.3克碳酸钠和氯化钠组成的固体混合物,加足量水溶解,制成溶液.向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示:
在一烧杯中盛有22.3克碳酸钠和氯化钠组成的固体混合物,加足量水溶解,制成溶液.向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示: