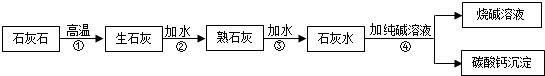
题目内容
2.现将铁粉和铜粉的混合物14克,加入到盛有116.2克稀盐酸的烧杯中,恰好完全反应.此时烧杯内各物质的总质量为129.8克.请你计算:(1)原混合物中铜粉的质量分数.
(2)反应后所得溶液中溶质的质量分数.
分析 (1)铁可以和盐酸反应,铜不会和盐酸反应,所以反应前后的质量差就是氢气的质量,然后写出化学方程式并代入氢气的质量即可计算出铁的质量.
(2)写出化学方程式并代入氢气的质量计算出氯化亚铁的质量和反应后溶液的质量.
解答 解:(1)根据题目信息可知,氢气的质量=14g+116.2g-129.8g=0.4g,设铁的质量为x,生成氯化亚铁的质量为y.
Fe+2HCl═FeCl2+H2↑
56 127 2
x y 0.4g
$\frac{56}{x}=\frac{127}{y}=\frac{2}{0.4g}$
x═11.2g
y=25.4g
(1)原混合物中铜粉的质量分数=$\frac{14g-11.2g}{14g}$×100%═20%.
(2)根据(1)的计算可知,铜的质量=14g-11.2g=2.8g,所以反应后溶液的质量=129.8g-2.8g=127g.
反应后所得溶液中溶质的质量分数=$\frac{25.4g}{127g}$×100%═20%.
答案:(1)混合物中铁的质量分数为20%;(2)反应后溶液中溶质的质量分数为20%.
点评 掌握化学方程式的计算格式和规范性,本题的易错点是反应后溶液的质量等于129.8克-铜的质量.

练习册系列答案
相关题目
5.化学实验中处处表现出变化美,下列化学实验中的现象不符合实验事实的是( )
| A. | 二氧化碳气体能使干燥的石蕊试液变红 | |
| B. | 铁在氧气中剧烈燃烧,火星四射,生成黑色固体 | |
| C. | 高温加热木炭与氧化铜的混合物,固体由黑色变成红色 | |
| D. | 硫在氧气中燃烧,火焰呈蓝紫色,生成有刺激性气味的气体 |
14.下列物质中最易与血红蛋白结合的是( )
| A. | 氧气 | B. | 二氧化碳 | C. | 一氧化碳 | D. | 氮气 |
12.下列叙述正确的是( )
| A. | 靑少年生长过程需要大量蛋白质因此要多吃水果 | |
| B. | 油脂和搪类都可以给人体提供能量 | |
| C. | 合金、合成纤维和合成塑料都是合成材料 | |
| D. | 人体缺钙易造成甲状腺肿大 |