题目内容
12.自1999年初,北京市政府采取措施,强制各用煤单位应使用低硫优质煤,主要是为了防止下列哪种气体对空气的污染( )| A. | 二氧化硫 | B. | 一氧化碳 | C. | 二氧化碳 | D. | 二氧化氮 |
分析 煤燃烧会产生CO、CO2、SO2及烟尘等污染物,具体选哪一个要抓住题干来分析.
解答 解:根据题干可知政府强调使用的是低硫煤,而煤中硫燃烧的反应是:S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,产生有毒的SO2,故使用低硫煤是为了减少SO2对空气的污染.
选故A
点评 此题考查的是硫燃烧产生对空气的污染物,主要是考查同学们对硫燃烧方程式的掌握,及同学们的审题能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3. 某学习小组对课本中“食盐常用于制氧气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主要部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下研究.
某学习小组对课本中“食盐常用于制氧气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主要部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下研究.
老师提示:
I.电解饱和食盐水的化学方程式:
2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑
Ⅱ.忽略其他可能发生的反应对本实验的影响.
探究活动一:检验待测液中含有氢氧化钠
(1)同学们选用某种酸碱指示剂对待测液进行检验,请你将实验报告填写完整.
探究活动二:测定待测液中氢氧化钠的质量分数
【实验】用沉淀法测定
资料摘要:氢氧化钠与氯化镁在溶液中发生反应:
同学们按如图所示的实验步骤进行实验:
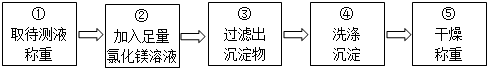
(2)步骤②加入的氯化镁溶液必需足量,其目的是使氢氧化钠完全反应.步骤④中判断沉淀物是否洗净的具体操作:取最后一次洗涤液少许于试管中,滴加硝酸银溶液,如果不产生白色沉淀,说明已经洗净,如果产生白色沉淀,说明没有洗净(写出实验步骤、现象和结论).
(5)步骤②中发生反应的化学方程式是2NaOH+MgCl2=Mg(OH)2↓+2NaCl.
(6)利用沉淀物的质量计算氢氧化钠的质量分数,若缺少步骤④的操作,所测定氢氧化钠的质量分数将偏大(选填“偏大”、“偏小”或“没影响”).
 某学习小组对课本中“食盐常用于制氧气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主要部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下研究.
某学习小组对课本中“食盐常用于制氧气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主要部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下研究.老师提示:
I.电解饱和食盐水的化学方程式:
2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑
Ⅱ.忽略其他可能发生的反应对本实验的影响.
探究活动一:检验待测液中含有氢氧化钠
(1)同学们选用某种酸碱指示剂对待测液进行检验,请你将实验报告填写完整.
| 实验步骤 | 实验现象 | 实验结论 |
| 待测液呈碱性,表明含有氢氧化钠. |
【实验】用沉淀法测定
资料摘要:氢氧化钠与氯化镁在溶液中发生反应:
同学们按如图所示的实验步骤进行实验:

(2)步骤②加入的氯化镁溶液必需足量,其目的是使氢氧化钠完全反应.步骤④中判断沉淀物是否洗净的具体操作:取最后一次洗涤液少许于试管中,滴加硝酸银溶液,如果不产生白色沉淀,说明已经洗净,如果产生白色沉淀,说明没有洗净(写出实验步骤、现象和结论).
(5)步骤②中发生反应的化学方程式是2NaOH+MgCl2=Mg(OH)2↓+2NaCl.
(6)利用沉淀物的质量计算氢氧化钠的质量分数,若缺少步骤④的操作,所测定氢氧化钠的质量分数将偏大(选填“偏大”、“偏小”或“没影响”).
20. 钛(Ti)因为具有许多神奇的性能而越来越引起人们的关注.某化学兴趣小组对Mg、Ti、Ag的金属活动性顺序进行探究.
钛(Ti)因为具有许多神奇的性能而越来越引起人们的关注.某化学兴趣小组对Mg、Ti、Ag的金属活动性顺序进行探究.
[提出假设]A.Ti>Mg>Ag; B.Mg>Ag>Ti; C.Mg>Ti>Ag.
[查阅资料]在相同条件下,金属与酸反应,产生气泡的速度越快,则该金属活动性越强.
[实验设计]同温下,取大小相同的这三种金属薄片,分别投入等体积、等质量分数的足量稀盐酸中,观察现象.请填空:
(1)三种金属加入盐酸前都先用砂纸将表面擦光亮,其目的是除去氧化膜,利于直接反应.
(2)根据下表中的实验现象填空:
[结论]假设C正确(填“A”或“B”或“C”)
(3)在做镁条与稀盐酸反应过程中观察到产生气体体积与反应时间有如图所示关系:
则t1~t2时间内反应速率逐渐加快的主要原因是反应放热,溶液温度升高使反应速率加快.
t2~t3时间内反应速率逐渐减慢的原因是盐酸溶液的浓度逐渐降低.
(4)在[实验设计]中,如果所用盐酸的溶质质量分数不同,是否一定能够得出正确结论?否(填“是”或“否”),理由是反应物的浓度不同,也会影响反应速度.
(5)你是否还知道其他方法来比较这三种金属的活动性(可供选择的药品:Ti、Mg、Ag、TiCl2溶液、MgCl2溶液、AgNO3溶液).
①金属Mg、Ag分别和TiCl2溶液反应;②MgCl2溶液、AgNO3溶液分别和金属Ti反应.
 钛(Ti)因为具有许多神奇的性能而越来越引起人们的关注.某化学兴趣小组对Mg、Ti、Ag的金属活动性顺序进行探究.
钛(Ti)因为具有许多神奇的性能而越来越引起人们的关注.某化学兴趣小组对Mg、Ti、Ag的金属活动性顺序进行探究.[提出假设]A.Ti>Mg>Ag; B.Mg>Ag>Ti; C.Mg>Ti>Ag.
[查阅资料]在相同条件下,金属与酸反应,产生气泡的速度越快,则该金属活动性越强.
[实验设计]同温下,取大小相同的这三种金属薄片,分别投入等体积、等质量分数的足量稀盐酸中,观察现象.请填空:
(1)三种金属加入盐酸前都先用砂纸将表面擦光亮,其目的是除去氧化膜,利于直接反应.
(2)根据下表中的实验现象填空:
| Ti | Mg | Ag | |
| 实验现象 | 产生气泡速度缓慢 | 产生气泡速度快 | 无任何现象 |
(3)在做镁条与稀盐酸反应过程中观察到产生气体体积与反应时间有如图所示关系:
则t1~t2时间内反应速率逐渐加快的主要原因是反应放热,溶液温度升高使反应速率加快.
t2~t3时间内反应速率逐渐减慢的原因是盐酸溶液的浓度逐渐降低.
(4)在[实验设计]中,如果所用盐酸的溶质质量分数不同,是否一定能够得出正确结论?否(填“是”或“否”),理由是反应物的浓度不同,也会影响反应速度.
(5)你是否还知道其他方法来比较这三种金属的活动性(可供选择的药品:Ti、Mg、Ag、TiCl2溶液、MgCl2溶液、AgNO3溶液).
①金属Mg、Ag分别和TiCl2溶液反应;②MgCl2溶液、AgNO3溶液分别和金属Ti反应.
17. 水是人及一切生物生存所必需的,我国人均水量约为世界人均水量的四分之一,许多地区已出现因水资源短缺影响人民生活.请你根据下表提供的水资源紧缺指标,判断如图所列我国部分省市中属于中度缺水省份的是( )
水是人及一切生物生存所必需的,我国人均水量约为世界人均水量的四分之一,许多地区已出现因水资源短缺影响人民生活.请你根据下表提供的水资源紧缺指标,判断如图所列我国部分省市中属于中度缺水省份的是( )
 水是人及一切生物生存所必需的,我国人均水量约为世界人均水量的四分之一,许多地区已出现因水资源短缺影响人民生活.请你根据下表提供的水资源紧缺指标,判断如图所列我国部分省市中属于中度缺水省份的是( )
水是人及一切生物生存所必需的,我国人均水量约为世界人均水量的四分之一,许多地区已出现因水资源短缺影响人民生活.请你根据下表提供的水资源紧缺指标,判断如图所列我国部分省市中属于中度缺水省份的是( )| 紧缺度 | 人均水量(m3/年) |
| 轻度缺水 | 1 700-3 000 |
| 中度缺水 | 1 000-1 700 |
| 重度缺水 | 500-1 000 |
| 极度缺水 | <500 |
| A. | 天津 | B. | 河北 | C. | 陕西 | D. | 黑龙江 |
1.食品安全日益受到人们关注,下列食品因有毒不能食用的是( )
| A. | 用含发酵粉(含碳酸氢钠和有机酸等)制作发面食品 | |
| B. | 用水浸过的大米、花生 | |
| C. | 用亚硝酸钠(NaNO2)代替食盐烹调的食品 | |
| D. | 食盐腌制的咸鸭蛋 |


 材料的应用,极大地促进了人类社会的发展和人们生活水平的提高.请从化学视角回答下列问题:
材料的应用,极大地促进了人类社会的发展和人们生活水平的提高.请从化学视角回答下列问题: