题目内容
3.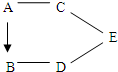 A、B、C、D、E为初中化学中不同类别的物质,它们的变化关系如图所示,其中棕红色物质A在一定条件下可以转化为单质B,“-”表示相连的两种物质能发生反应,“→”表示相连的两种物质能转化.则:
A、B、C、D、E为初中化学中不同类别的物质,它们的变化关系如图所示,其中棕红色物质A在一定条件下可以转化为单质B,“-”表示相连的两种物质能发生反应,“→”表示相连的两种物质能转化.则:(1)E的化学式可能为NaOH等可溶性的碱;
(2)A与C反应的化学方程式可能是Fe2O3+6HCl═2FeCl3+3H2O(合理即可),该反应属于复分解反应.(填写基本反应类型)
分析 本题的解题突破口为红色物质A在一定条件下可以转化为单质B,根据所学的知识,红色物质A为氧化铁,生成的单质B为铁,铁可以与酸和某些盐溶液反应,若D是硫酸铜,则E可以是碱类物质,E可能为氢氧化钠,则可以与氢氧化钠反应的物质为酸,酸可以与金属氧化物反应,然后将推出的物质进行验证即可.
解答 解:红色物质A在一定条件下可以转化为单质B,根据所学的知识,红色物质A为氧化铁,生成的单质B为铁,铁可以与酸和某些盐溶液反应,若D是硫酸铜,则E可以是碱类物质,E可能为氢氧化钠,则可以与氢氧化钠反应的物质为酸,酸可以与金属氧化物反应,验证符合转化关系,因此:
(1)E是可溶性的碱类物质,可以为氢氧化钠,故填:NaOH等可溶性的碱;
(2)A为氧化铁,C为酸,如盐酸,盐酸和氧化铁反应产生氯化铁和水,该反应是两种化合物相互交换成分产生两种新的化合物,属于复分解反应;
故填:Fe2O3+6HCl═2FeCl3+3H2O(合理即可);复分解反应.
点评 本题为物质推断题,找准解题突破口,直接得出结论,然后顺推或逆推或从两边向中间推得出其他物质的化学式.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
13.根据图某反应微观示意图判断下列说法正确的是( )


| A. | 参加反应的甲和乙分子个数比为4:1 | |
| B. | 该反应属于置换反应 | |
| C. | 反应前后原子的种类、数目都不变 | |
| D. | 反应前后各种元素的化合价都不变 |
14.化学在生活中用途广泛.下列有关说法正确的是( )
| A. | 可用点燃的方法检验天然气是否泄漏 | |
| B. | 回收废弃的塑料可以减少“白色污染” | |
| C. | 食用甲醛水溶液浸泡过的海产品对人体无害 | |
| D. | 在香肠中添加过量的亚硝酸钠保持肉质鲜美 |
11.我国大部分地区深受酸雨的危害,煤燃烧产生的SO2是形成酸雨的主要污染物,SO2与水结合生成弱酸性亚硫酸(H2SO3).
已知:H2SO3易分解生成水和SO2,也易与空气中的氧气或稀硝酸反应生成H2SO4;H2SO3和SO2都能使红色的品红溶液褪色.
(1)酸雨是pH小于5.6的降雨.
(2)常用脱硫方法减少废气中的SO2,以生石灰(CaO)为脱硫剂,高温下与废气中的SO2
与O2化合生成CaSO4,化学方程式为2CaO+2SO2+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4
(3)实验室常用亚硫酸盐与HCl或H2SO4反应制备SO2,Na2SO3与盐酸发生反应的基本类型为Na2SO3+2HCl═2NaCl+H2O+SO2↑
(4)小明同学利用中和反应的原理,在空气中放置一段时间的酸雨(pH约为3)中加入足
量的NaOH,并就反应后混合溶液的中盐成分进行如下探究:
[提出问题]反应后的混合溶液中盐的成份是什么?
[进行猜想]猜想1:只有Na2SO3
猜想2:只有Na2SO4
猜想3:既有Na2SO4,也有Na2SO3
[实验探究]限选试剂:稀硫酸、稀盐酸、稀硝酸、氯化钡溶液、澄清石灰水、品红溶液、紫色石蕊溶液
已知:H2SO3易分解生成水和SO2,也易与空气中的氧气或稀硝酸反应生成H2SO4;H2SO3和SO2都能使红色的品红溶液褪色.
(1)酸雨是pH小于5.6的降雨.
(2)常用脱硫方法减少废气中的SO2,以生石灰(CaO)为脱硫剂,高温下与废气中的SO2
与O2化合生成CaSO4,化学方程式为2CaO+2SO2+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4
(3)实验室常用亚硫酸盐与HCl或H2SO4反应制备SO2,Na2SO3与盐酸发生反应的基本类型为Na2SO3+2HCl═2NaCl+H2O+SO2↑
(4)小明同学利用中和反应的原理,在空气中放置一段时间的酸雨(pH约为3)中加入足
量的NaOH,并就反应后混合溶液的中盐成分进行如下探究:
[提出问题]反应后的混合溶液中盐的成份是什么?
[进行猜想]猜想1:只有Na2SO3
猜想2:只有Na2SO4
猜想3:既有Na2SO4,也有Na2SO3
[实验探究]限选试剂:稀硫酸、稀盐酸、稀硝酸、氯化钡溶液、澄清石灰水、品红溶液、紫色石蕊溶液
| 步骤 | 实验操作 | 预期现象和结论 |
| 1 | 各取2mL反应后的混合溶液分别加入A、B两只试管中 | 多余空 |
2 | 向A试管中滴加足量的稀硫酸,随即滴入几滴红色品红溶液 | 有气泡产生,品红溶液褪色,证明含有Na2SO3 |
3 | 向B试管中,加入足量的氯化钡溶液溶液,再加入足量的稀盐酸 | 先有白色沉淀,后有气体产生,沉淀部分溶解,证明含有Na2SO4,则猜想3成立 |
18.为了除去物质中的杂质(括号内为杂质),如表方法正确的是( )
| 物 质 | 方法 |
| A.C(CuO) | 通入足量的CO后加热 |
| B.CaCl2溶液(HCl) | 加入过量Ca(OH)2溶液,使其充分反应 |
| C.CuSO4(H2SO4) | 加入过量CuO粉末,充分反应后过滤 |
| D.CO2(CO) | 点燃 |
| A. | A | B. | B | C. | C | D. | D |
8.逻辑推理是化学学习常用的思维方法.下列观点正确的是( )
| A. | 酸的溶液pH值小于7,碱的溶液pH大于7,所以盐的溶液pH值一定等于7 | |
| B. | 在同一化合物中,金属元素显正价,所以非金属元素一定显负价 | |
| C. | 氧化物只含有两种元素,所以氧化物中一定有一种元素不是氧元素 | |
| D. | 酸碱中和反应生成盐和水,所以生成盐和水的反应一定是中和反应 |
15.下列推理合理的是( )
| A. | 中和反应生成盐和水,所以生成盐和水的反应一定是中和反应 | |
| B. | CO2能灭火,既利用了CO2的物理性质又利用了CO2的化学性质 | |
| C. | 碱溶液能使酚酞变红,所以能使酚酞变红的试液一定是碱溶液 | |
| D. | 酸性溶液的pH<7,所以pH<7的雨水是酸雨 |
12.食品卫生与身体健康密切相关,下列做法会导致食品对人体有害的是( )
①用加入三聚氰胺来提高奶粉的含氮量
②用福尔马林(甲醛的水溶液)浸泡海鲜产品来保鲜
③用小苏打(碳酸氢钠)发面做馒头使其松软可口
④用硫磺熏制生姜或种植时使用农药神农丹.
①用加入三聚氰胺来提高奶粉的含氮量
②用福尔马林(甲醛的水溶液)浸泡海鲜产品来保鲜
③用小苏打(碳酸氢钠)发面做馒头使其松软可口
④用硫磺熏制生姜或种植时使用农药神农丹.
| A. | ①③ | B. | ①②③ | C. | ①②④ | D. | ②③④ |
13.城市垃圾问题日益恶化,对环境以及人类健康构成严重威胁.下列说法不正确的是( )
| A. | 城市生活垃圾可以导致空气、水体和土壤污染 | |
| B. | 减少城市垃圾的最佳途径是焚烧城市垃圾 | |
| C. | 城市建筑工地的垃圾会增加空气中PM2.5的含量 | |
| D. | 城市内一次性塑料制品的使用加剧了城市垃圾的排放 |