题目内容
19. 实验室新购买了一批双氧水(H2O2)溶液,某兴趣小组的同学要测定其质量分数,他们设计如图所示的装置,其实验的操作步骤如下:
实验室新购买了一批双氧水(H2O2)溶液,某兴趣小组的同学要测定其质量分数,他们设计如图所示的装置,其实验的操作步骤如下:①组装仪器,并检查装置的气密性;
②在A、B、C三个仪器中装入药品,其中双氧水溶液质量为50g;
③用电子秤称量出整套装置的总质量为498.6g;
④关闭a处止水夹,打开A仪器的阀门,向锥形瓶中加入全部的双氧水溶液,随即关闭A仪器的阀门;
⑤充分反应后,打开a处止水夹,向装置中持续缓慢地鼓入X气体;
⑥第二次称量整套装置的总质量为497g.
(1)本实验采用的装置中,A仪器的名称是分液漏斗
(2)为尽可能减小测量误差,请结合测量原理判断,操作⑤中鼓入的X气体是B.
A.氦气 B.经干燥处理的空气 C.除去氧气后的空气
(3)根据题意,计算双氧水溶液中溶质的质量分数,写出计算过程.
分析 (1)根据实验室常用仪器解答;
(2)鼓入X气体的目的是将装置中的氧气排除;
(3)根据质量守恒定律计算生成氧气的质量,结合方程式计算过氧化氢的质量,进一步计算双氧水溶液中溶质的质量分数.
解答 解:(1)根据实验室常用仪器可知:A仪器的名称是分液漏斗;故填:分液漏斗;
(2)鼓入X气体的目的是将装置中的氧气排除,为了不影响装置反应后的质量,要通入经干燥处理的空气;故填:B;
(3)生成氧气的质量为:498.6g-497g=1.6g,
2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,
68 32
x 1.6g
$\frac{68}{32}$=$\frac{x}{1.6g}$
x=3.4g,
该双氧水溶液中质量的质量分数为:$\frac{3.4g}{50g}$×100%=6.8%,
答:该双氧水溶液中质量的质量分数为6.8%.
点评 本题主要考查学生运用化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
10.类推是学习化学的一种重要方法,但不恰当的类推又可能得出错误结论.以下类推正确的是( )
| A. | 原子和分子均是微观粒子,在化学变化中原子不能再分,则分子也不能再分 | |
| B. | 碱能跟非金属氧化物反应,则碱溶液一定能吸收二氧化碳、二氧化硫和一氧化碳气体 | |
| C. | 中和反应是酸和碱作用生成盐和水,则生成盐和水的反应不一定是中和反应 | |
| D. | 碳酸盐能与酸反应产生CO2,则与酸反应产生CO2的物质中一定含有CO32- |
7.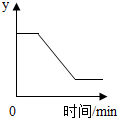 已知:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.如图表示一定质量的KClO3和MnO2固体混合物受热过程中,某变量随时间的变化趋势,纵坐标表示的是( )
已知:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.如图表示一定质量的KClO3和MnO2固体混合物受热过程中,某变量随时间的变化趋势,纵坐标表示的是( )
 已知:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.如图表示一定质量的KClO3和MnO2固体混合物受热过程中,某变量随时间的变化趋势,纵坐标表示的是( )
已知:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.如图表示一定质量的KClO3和MnO2固体混合物受热过程中,某变量随时间的变化趋势,纵坐标表示的是( )| A. | 固体中氧元素的质量 | B. | 生成氧气的质量 | ||
| C. | 固体中二氧化锰的质量 | D. | 固体中钾元素的质量分数 |
14. 许多干果、糕点等食品的包装袋内,都有一个装有活性铁粉脱氧保鲜剂(也称脱氧剂)的塑料小包,为什么放脱氧剂?王芳同学对家庭废弃的脱氧剂进行了探究:
许多干果、糕点等食品的包装袋内,都有一个装有活性铁粉脱氧保鲜剂(也称脱氧剂)的塑料小包,为什么放脱氧剂?王芳同学对家庭废弃的脱氧剂进行了探究:
①仔细观察,发现脱氧剂塑料包上有许多小孔,王芳认为这些小孔的作用可能是利于活性铁粉脱氧保鲜剂与氧气、水分接触;
②挤捏塑料包质感较硬,剪开塑料包将里面的脱氧剂倒在纸上,脱氧剂呈红褐色并已结块,王芳得出活性铁粉已部分被氧化的结论,由此推断,食品包装袋中放入脱氧剂的目的是除去包装袋内的氧气;
③为弄清上述脱氧剂有哪些成分,王芳将其带进实验室,进行继续探究:
 许多干果、糕点等食品的包装袋内,都有一个装有活性铁粉脱氧保鲜剂(也称脱氧剂)的塑料小包,为什么放脱氧剂?王芳同学对家庭废弃的脱氧剂进行了探究:
许多干果、糕点等食品的包装袋内,都有一个装有活性铁粉脱氧保鲜剂(也称脱氧剂)的塑料小包,为什么放脱氧剂?王芳同学对家庭废弃的脱氧剂进行了探究:①仔细观察,发现脱氧剂塑料包上有许多小孔,王芳认为这些小孔的作用可能是利于活性铁粉脱氧保鲜剂与氧气、水分接触;
②挤捏塑料包质感较硬,剪开塑料包将里面的脱氧剂倒在纸上,脱氧剂呈红褐色并已结块,王芳得出活性铁粉已部分被氧化的结论,由此推断,食品包装袋中放入脱氧剂的目的是除去包装袋内的氧气;
③为弄清上述脱氧剂有哪些成分,王芳将其带进实验室,进行继续探究:
| 实验内容 | 实验现象 | 结论与化学反应方程式 |
| 取部分红褐色并已结块的脱氧剂放入试管中,倒入足量稀盐酸,随脱氧剂的溶解,观察现象. | 脱氧剂溶解,溶液变黄色,有气泡产生 | 已结块的脱氧剂中含有铁粉、氧化铁;反应的化学方程式为:Fe2O3+6HCl═2FeCl3+3H2O、Fe+2HCl═FeCl2+H2↑. |
4.下列推理或说法中,正确的是( )
①饱和溶液不能继续溶解某种溶质,则饱和溶液也不能继续溶解其他溶质;②Na2MoO4中钼(Mo)元素的化合价是+6价;③盐是由金属离子和酸根离子组成,NH4NO3中没有金属离子,不属于盐;④化学变化中,原子的种类和个数不变;⑤带电的微粒都称为离子;⑥NaOH溶液中的OH-能与酸反应,则KOH溶液中的OH-也能与酸反应.
①饱和溶液不能继续溶解某种溶质,则饱和溶液也不能继续溶解其他溶质;②Na2MoO4中钼(Mo)元素的化合价是+6价;③盐是由金属离子和酸根离子组成,NH4NO3中没有金属离子,不属于盐;④化学变化中,原子的种类和个数不变;⑤带电的微粒都称为离子;⑥NaOH溶液中的OH-能与酸反应,则KOH溶液中的OH-也能与酸反应.
| A. | ①②④ | B. | ②④⑥ | C. | ①③⑤ | D. | ③⑤⑥ |
1.如图是甲、乙两位同学一起在实验室进行的氢氧化钠与盐酸中和反应的实验.(图中A1、A2、A3、B1、B2、B3均为溶液编号)

根据图中实验,请你与甲、乙同学一起完成下列探究:

根据图中实验,请你与甲、乙同学一起完成下列探究:
| 探究 环节 | 甲同学的探究 | 乙同学的探究 |
| 提出 问题 | A3溶液为什么不变红? | B3溶液中溶质成分是什么?(酚酞不计) |
| 做出 猜想 | 实验过程中,酚酞变质了? | 猜想一:NaCl 猜想二:NaCl HCl |
实验 验证 | (1)取少量A3溶液于另一试管中,向其中滴加NaOH溶液,溶液变红,说明甲同学的猜想不成立(填“成立”或“不成立”) (2)你认为在常温下A2溶液测出的pH <(填“>”、“=”或“<”)7 | 取少量B3溶液加入盛有少量铁粉的试管中,观察到有无色气泡产生,固体逐渐减少,溶液由无色变浅绿色,你认为乙同学的猜想二.(填“一”或“二”)成立 |
交流 反思 | (1)甲、乙同学的实验中,反应均涉及到的化学方程式是NaOH+HCl=NaCl+H2O. (2)A3溶液未变红,你认为原因是A2溶液中盐酸较多,加入的NaOH溶液未将其完全中和. (3)甲、乙同学经过实验对比探究,认为做化学实验时应注意药品用量的控制. | |

 我国古代将炉甘石(主要成分:ZnCO3)、赤铜矿(主要成分:Cu2O)和木炭粉为原料值得来黄铜(铜和锌的合金,外观似黄金),其生产流程如下:
我国古代将炉甘石(主要成分:ZnCO3)、赤铜矿(主要成分:Cu2O)和木炭粉为原料值得来黄铜(铜和锌的合金,外观似黄金),其生产流程如下: