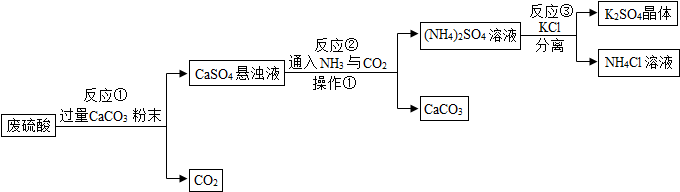
题目内容
19.如图1所示是实验室制取和收集气体的装置,请按要求作答: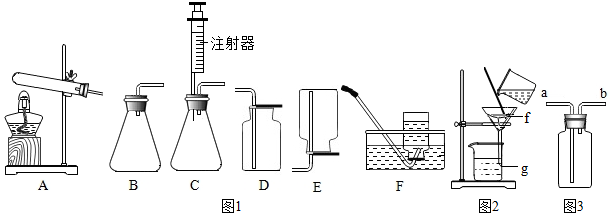
(1)实验室常用双氧水和二氧化锰制氧气,二氧化锰所起的作用是催化作用;欲通过平稳的气流得到较纯净的氧气,应选用的发生装置和收集装置依次是CF.(填字母)
(2)选用装置A和F通过加热KMnO4制取O2并收集O2,反应的化学方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,待高锰酸钾完全反应后,用如图2方法回收生成物中的二氧化锰,则二氧化锰在如图2中的f处(选“f”或“g”).
(3)实验室制取并收集CO2应选用的装置是如图1中的BD(或CD)(填字母),反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;
(4)用如图3装置排空气收集H2,气体应从导管的b(填“a”或“b”)端进入.
(5)取10g粗锌与足量的一定质量分数的稀硫酸充分反应后,称得剩余固体的质量为3.5g,则生成氢气的质量为多少?
分析 (1)二氧化锰在双氧水分解反应中起催化作用,该反应不需加热,属于固液常温型,要得到平稳的氧气流,则须控制反应物的量,要收集较纯净的氧气用排水法;
(2)据反应原理书写方程式,二氧化锰不溶于水,故过滤后留在滤纸上;
(3)实验室制取二氧化碳用大理石或石灰石和稀盐酸常温混合,属于固液常温型,故可用B或C发生装置,据二氧化碳密度和溶解性选择收集装置,据反应原理书写方程式;
(4)氢气密度比空气小;
(5)稀硫酸足量,则锌完全反应,剩余固体是杂质的质量,粗锌中锌的质量是10g-3.5g=6.5g,并结合方程式计算生成氢气的质量.
解答 解:(1)用双氧水和二氧化锰制氧气不需要加热,其中二氧化锰起催化作用,C装置中注射器可逐滴滴加液体,进而可控制反应速率,氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集,排水法收集的氧气比较纯净;
(2)高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,反应方程式是:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;二氧化锰不溶于水,过滤后留在滤纸上;
(3)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,故可用B或C发生装置,二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,反应方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(4)用如图3装置排空气法收集H2,气体应从导管的b端进入,因为氢气的密度比空气小;
(5)解:锌的质量=10g-3.5=6.5g,
设生成H2的质量为x
Zn+H2SO4=ZnSO4 +H2↑
65 2
6.5g x
$\frac{65}{2}$=$\frac{6.5g}{x}$
x=0.2g
故答案为:
(1)催化作用;C F;
(2)2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;f;
(3)BD(或CD);BD或CD;CaCO3+2HCl=CaCl2+H2O+CO2↑;
(4)b;
(5)答:生成H2的质量为0.2g.
点评 本考点主要考查了气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和有关化学方程式的计算等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.

| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量/g | 20 | 3 | 2 | 20 |
| 反应后质量/g | X | 28 | 2 | 0 |
| A. | 该反应的基本类型为化合反应 | |
| B. | 反应后甲物质的质量值x=15 | |
| C. | 物质丙可能是该反应的催化剂 | |
| D. | 参加反应的丁物质与生成的乙物质的质量比为4:7 |
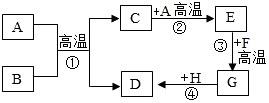 A-H都是初中化学常见的物质,它们的转化关系如图所示.A、B均为黑色粉末:D、F为红色固体,且D为单质;C能使澄清石灰水变浑浊.请回答:
A-H都是初中化学常见的物质,它们的转化关系如图所示.A、B均为黑色粉末:D、F为红色固体,且D为单质;C能使澄清石灰水变浑浊.请回答: