题目内容
7.铁及其化合物在生活生产中有重要的应用.请回答下列问题:A、在盛有氧气的集气瓶中点燃细铁丝发生剧烈燃烧的化学方程式是3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4,为防止集气瓶破裂,常采取的措施是预先在集气瓶底部放一些水或细沙.
B、已知铁能与氯化铁反应生成氯化亚铁.将生锈的铁钉(铁锈的主要成分是Fe2O3)放入盐酸中,充分反应后有铁剩余,写出发生置换反应的化学方程式Fe+2HCl═FeCl2+H2↑,溶液中的金属阳离子是Fe2+(用符号表示).
C、工业上用CO还原赤铁矿冶炼金属铁的化学方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
D、把铁粉和铜粉的混合物放入硝酸银溶液中,反应结束后有固体剩余.下列说法正确的是①④(填写字母序号).①剩余固体肯定含有银 ②剩余固体肯定是银和铜③反应后溶液中一定有Fe2+和Cu2+.④反应后溶液中可能含有Ag+和Cu2+.
分析 (1)据铁丝与氧气的反应原理书写方程式,并据铁丝燃烧实验的注意事项分析解答;
(2)铁锈主要成分是氧化铁,放入稀盐酸后首先是铁锈反应,铁锈完全反应后铁和稀盐酸反应产生气泡,据此分析解答即可;
(3)工业上用一氧化碳还原氧化铁炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,写出反应的化学方程式即可;
(4)根据三种金属活动性强弱关系铁>铜>银,对将铁粉和铜粉的混合物放入硝酸银溶液中可能出现的变化进行分析,判断反应结束后剩余固体成分.
解答 解:
(1)铁丝与氧气在点燃的条件下生成四氧化三铁,其反应的化学方程式是3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4,为防止铁丝燃烧生成的高温熔融物溅落瓶底使集气瓶破裂,常采取的措施是预先在集气瓶底部放一些水或少量沙子;
(2)生锈的铁钉放入稀盐酸中,先是表面的铁锈的主要成分氧化铁与盐酸反应生成氯化铁与水,当铁锈完全反应后铁与稀盐酸发生反应,生成氯化亚铁与氢气,反应的化学方程式为:Fe+2HCl═FeCl2+H2↑.
(2)工业上用一氧化碳还原氧化铁炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,反应的化学方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(4)①根据三种金属活动性强弱关系铁>铜>银,将铁粉和铜粉的混合物放入硝酸银溶液中,铁粉、铜粉都能与硝酸银发生反应得到银,因此剩余固体中一定含有银,故①正确;
②因未说明混合物的用量,因此对于固体混合物是否出现剩余则无法准确判断,因此肯定有银、可能有铜,故②错误;
③多种金属与一种金属盐溶液反应时最活泼的金属先反应,铁首先与硝酸银反应生成硝酸亚铁和银,铜再与硝酸银完全反应生成硝酸铜和银,故滤液中一定含有生成的硝酸亚铁和硝酸铜,因此滤液中一定有Fe2+,
如果铁粉足够多把所有硝酸银反应完,那铜粉就无法与硝酸银发生反应,此时溶液中不一定含有Cu2+,故③错误;
如果铁粉不足不能把所有硝酸银反应完,那铜粉就与硝酸银发生反应,此时溶液中一定含有Cu2+,还可能
有剩余的Ag+,故④正确;
故选①④.
答案:
(1)3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4 预先在集气瓶底部放一些水或细沙
(2)Fe+2HCl═FeCl2+H2↑. Fe2+
(3)Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
(4)①④
点评 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等,根据金属活动顺序表,活动性强的金属能将活动性弱的金属从其盐溶液中置换出来的有关知识.

| A. |  | B. |  | C. |  | D. |  |
 2015年合肥科技周,中科大展示了中国核能的发展及展望,一千克浓缩铀释放出的能量相当于1500吨煤用于发电.如图是元素周期表中放射性元素铀的信息示意图,对图中信息解释不正确的是:( )
2015年合肥科技周,中科大展示了中国核能的发展及展望,一千克浓缩铀释放出的能量相当于1500吨煤用于发电.如图是元素周期表中放射性元素铀的信息示意图,对图中信息解释不正确的是:( )| A. | 质子数为92 | B. | 相对原子质量为238.0 | ||
| C. | 属于非金属元素 | D. | 中子数为146 |
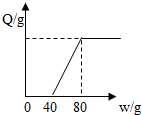 向100g含有氯化氢和氯化镁的混合溶液中加入20%的氢氧化钠溶液,产生沉淀的质量Q与加入氢氧化钠溶液的质量W的关系如图所示,则原混合溶液中氯元素的质量分数为( )
向100g含有氯化氢和氯化镁的混合溶液中加入20%的氢氧化钠溶液,产生沉淀的质量Q与加入氢氧化钠溶液的质量W的关系如图所示,则原混合溶液中氯元素的质量分数为( )| A. | 14.2% | B. | 7.1% | C. | 3.55% | D. | 10% |
| A. | 氧气质量约占空气总质量的$\frac{1}{5}$ | |
| B. | 氧气可以支持燃烧,说明氧气具有可燃性 | |
| C. | 工业上用分离液态空气法制取氧气是分解反应 | |
| D. | 氧气供给呼吸,它和体内物质反应,释放能量,维持生命活动 |
 4月6日,福建古雷石化(PX项目)厂区发生爆炸,经过消防官兵几天的奋战,成功扑灭大火.PX是一种重要的化工原料,从化纤织物到食品包装,从医疗设备到家用电器,都要用到它的合成产物.PX的化学名称为对二甲苯,是一种低毒化合物,请回答:
4月6日,福建古雷石化(PX项目)厂区发生爆炸,经过消防官兵几天的奋战,成功扑灭大火.PX是一种重要的化工原料,从化纤织物到食品包装,从医疗设备到家用电器,都要用到它的合成产物.PX的化学名称为对二甲苯,是一种低毒化合物,请回答: