题目内容
6.某同学在实验室用三支试管分别取适量的稀盐酸、澄清石灰水、碳酸钠溶液,进行相关实验探究:步骤1:向三支试管中分别滴加酚酞,Na2CO3溶液中显红色,则Na2CO3溶液显碱性;
步骤2:该同学把步骤1三支试管中的溶液同时倒入一只烧杯中,发现有气泡产生,最终有沉淀生成且溶液显红色;
步骤3:把烧杯中的混合物进行过滤,所得滤液中一定不含有原3种物质中的稀盐酸;(填物质名称)
(1)提出部分假设.步骤3所得滤液中溶质可能为:
假设①:NaCl Na2CO3; 假设②:NaCl CaCl2和NaOH;
假设③:NaCl Na2CO3和NaOH; 假设④:NaCl CaCl2和Na2CO3.
上述假设中,你认为不合理的假设是④(填序号),理由是CaCl2+Na2CO3═CaCO3↓+2NaCl(用化学方程式表示).
(2)完成实验方案.请填写与表中结论相符的实验现象.(提示CaCl2溶液显中性)
| 实验操作 | 实验现象 | 实验结论 |
| 取少量滤液于试管中,加入足量CaCl2溶液,振荡 | 猜想③成立 |
分析 根据酚酞试液在碱性溶液中为红色,碳酸盐遇酸会生成二氧化碳气体,溶液中钙离子和碳酸根离子结合生成碳酸钙沉淀,碳酸钠能与氯化钙反应生成碳酸钙沉淀等知识进行分析.
解答 解:步骤1:酚酞在碳酸钠溶液中为红色,说明碳酸钠溶液呈碱性;
步骤3:根据步骤2,当倒入同一只烧杯中时有气泡产生,且有白色沉淀溶液显红色,说明最终溶液显碱性,而碳酸钠溶液、石灰水显碱性,所以溶液中一定不含有盐酸;
碳酸根离子和钙离子会生成碳酸钙沉淀,碳酸钠和氯化钙不能共存,会生成碳酸钙沉淀和氯化钠,所以不合理的假设是④,理由是:CaCl2+Na2CO3═CaCO3↓+2NaCl;
【实验验证】:若猜想③成立,则溶液中的溶质需要证明含有碳酸钠和氢氧化钠,可以取滤液,加入足量的氯化钙溶液,则由于碳酸钠与氯化钙反应产生碳酸钙沉淀,而观察到溶液变浑浊的现象,溶液仍然呈红色,说明仍然含有氢氧化钠;氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠,反应方程式是:CaCl2+Na2CO3═CaCO3↓+2NaCl;
【反思评价】若改为盐酸,只能证明碳酸钠的存在,无法证明氢氧化钠的存在,所以不正确,因为盐酸与氢氧化钠溶液反应生成水,酚酞试液显无色.
故答案为:步骤1:碱;
步骤3:稀盐酸;
④,CaCl2+Na2CO3═CaCO3↓+2NaCl;
【实验验证】
| 实验操作 | 实验现象 | 实验结论 |
| 有白色沉淀产生 溶液仍为红色 |
点评 本题考查了混合溶液成分的推断,完成此题,可以依据题干提供的信息结合物质的性质进行,要结合所学知识细心分析解答,能很好考查学生分析、解答问题的能力.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
17.下列实验操作叙述正确的是( )
| A. | 倾倒液体时,试剂瓶口紧挨着试管口快速倒入 | |
| B. | 加热蒸发过程中,当溶液蒸干时停止加热 | |
| C. | 用pH试纸测定溶液的酸碱度时,将pH试纸放入待测液中蘸取 | |
| D. | 过滤时,漏斗中液面低于滤纸的边缘 |
14.下列有关燃烧的说法不正确的是 ( )
| A. | 发生森林火灾要开辟隔离带,目的是清除可燃物 | |
| B. | 白磷保存在冷水中目的是为了隔绝氧气 | |
| C. | 将煤块制成蜂窝煤是为了使其燃烧更充分 | |
| D. | 用水灭火目的是为了降低可燃物的着火点 |
11.下列实验现象的描述不正确的是( )
| A. | 纯羊毛制品点燃后有烧焦羽毛气味产生 | |
| B. | 黄铜片与铜片互相刻画,铜片上出现痕迹 | |
| C. | 硫在空气中燃烧产生明亮的蓝紫色火焰 | |
| D. | 聚乙烯塑料颗粒加热时变成液体,冷却后又变成固体 |
 某化学兴趣小组在实验室配制一定溶质质量分数的稀盐酸,并用其测定某氢氧化钠溶液的溶质质量分数.
某化学兴趣小组在实验室配制一定溶质质量分数的稀盐酸,并用其测定某氢氧化钠溶液的溶质质量分数. 教材上有一幅很形象的卡通画表示金属与盐酸的反应现象.卡通人物表示一种金属,周围的小黑点表示反应中生成的气体,如图所示:
教材上有一幅很形象的卡通画表示金属与盐酸的反应现象.卡通人物表示一种金属,周围的小黑点表示反应中生成的气体,如图所示: 小伟善于利用身边的物质巩固所学的知识,如图是他利用窗户进行的巩固性练习,请你用化学符号帮他填写完成各项内容:
小伟善于利用身边的物质巩固所学的知识,如图是他利用窗户进行的巩固性练习,请你用化学符号帮他填写完成各项内容:
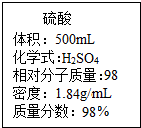 实验室有一瓶浓硫酸,瓶上标签如图,请根据标签上提供的数据解答下列问题.
实验室有一瓶浓硫酸,瓶上标签如图,请根据标签上提供的数据解答下列问题.