题目内容
14.精还原铁粉在化学工业上有着重要的用途,某兴趣小组的同学们对其进行下列探究:【物质制备】利用绿矾制备精还原铁粉的工艺流程如下:

粗还原铁粉中还含有少量铁的氧化物和Fe3C杂质,可用氢气在高温下进一步还原,其反应方程式为FexOy+yH2$\frac{\underline{\;高温\;}}{\;}$x Fe+yH2O,Fe3C+2 H2$\frac{\underline{\;高温\;}}{\;}$3 Fe+CH4.
(1)请你写出焙烧中氧化铁与CO反应的化学方程式:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
【含量测定】为得到精还原铁粉并测定粗还原铁粉中氧和碳元素的质量分数,按如下装置进行实验.已知3 CH4 +4 Fe2O3$\frac{\underline{\;高温\;}}{\;}$3CO2 +6H2O+8Fe(假设每步反应都完全,且不考虑装置内原有空气对测定结果的影响).

(2)主要实验步骤如下:
①按顺序组装仪器,检查装置的气密性,称量样品和必要装置的质量②缓缓通入纯净干燥的H2;③点燃C处酒精灯;④点燃A处酒精灯⑤分别熄灭A处、C处酒精灯;⑥继续通H2直至装置冷却;⑦再次称量必要装置的质量.
写出步骤⑥的操作并写出这一步骤的目的防止生成的还原铁粉再次被氧化.
(3)实验装置中,若缺少装置D,则所测氧元素的质量分数将不变(填“偏大”“偏小”或“不变”),若粗还原铁粉的质量为M,装置B增重的质量为m1,装置D增重的质量为A2,装置E增重的质量为m3,求粗还原铁粉中碳元素的质量分数(假设每一步都完全吸收)$\frac{3{m}_{3}}{11M}$×100%.
分析 (1)氧化铁和一氧化碳在高温条件下反应生成铁和二氧化碳;
(2)步骤⑥的目的是 防止生成的还原铁粉再次被氧化,起保护作用;
(3)若缺少装置D,不影响测氧元素的质量分数;实验后,甲同学根据装置E的增重算得样品中碳元素的质量分数.
解答 解:(1)氧化铁在高温条件下能与CO发生反应生成铁与二氧化碳,反应的化学方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;故填:Fe2O3+3CO$\frac{\underline{\;点燃\;}}{\;}$2Fe+3CO2.
(2)主要实验步骤如下:
①按顺序组装仪器,检查装置的气密性,称量样品和必要装置的质量;
②缓缓通入纯净干燥的H2;
③点燃C处酒精灯;
④点燃A 处酒精灯;
⑤分别熄灭A、C处酒精灯;
⑥继续通H2直至装置冷却;
⑦再次称量必要装置的质量.步骤⑥的目的是防止生成的还原铁粉再次被氧化,起保护作用.
故填:继续通H2直至装置冷却;防止生成的还原铁粉再次被氧化.
(3)若缺少装置D,则所测氧元素的质量分数将不变,这是因为需要的水的质量数据是从B装置得到的.
装置E增重m3,则甲烷与氧化铁反应生成二氧化碳的质量为m3,生成二氧化碳中碳元素质量=m3×$\frac{12}{44}$=$\frac{3}{11}$m3;样品中碳元素的质量分数=$\frac{\frac{3}{11}{m}_{3}}{M}$×100%=$\frac{3{m}_{3}}{11M}$×100%.
故填:不变;$\frac{3{m}_{3}}{11M}$×100%.
点评 通过对铁冶炼原理的知识迁移,理解该题的实验过程及目的,考查了知识的运用及实验分析的能力.

练习册系列答案
相关题目
8.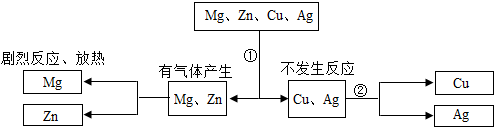 某同学为探究镁、锌、铜、银的活动性顺序,设计如图实验流程:依据流程设计,下面对物质①②的选择合理的是( )
某同学为探究镁、锌、铜、银的活动性顺序,设计如图实验流程:依据流程设计,下面对物质①②的选择合理的是( )
 某同学为探究镁、锌、铜、银的活动性顺序,设计如图实验流程:依据流程设计,下面对物质①②的选择合理的是( )
某同学为探究镁、锌、铜、银的活动性顺序,设计如图实验流程:依据流程设计,下面对物质①②的选择合理的是( )| A. | ①稀硫酸②硝酸银 | B. | ①稀盐酸②硫酸锌 | ||
| C. | ①稀盐酸②硫酸亚铁 | D. | ①稀硫酸②氯化镁 |
9. 常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体.小明很好奇,设计如下实验探究铁粉与水蒸气反应后的产物.
常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体.小明很好奇,设计如下实验探究铁粉与水蒸气反应后的产物.
(1)探究生成的气体是什么?用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中.说明生成的气体是H2.
(2)探究试管中剩余固体成分是什么?
【查阅资料】
【初步验证】试管中剩余固体为黑色,能全部被磁铁吸引.
【猜想与假设】猜想一:剩余固体是Fe与Fe3O4;猜想二:剩余固体是Fe3O4.
【实验探究】
 常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体.小明很好奇,设计如下实验探究铁粉与水蒸气反应后的产物.
常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体.小明很好奇,设计如下实验探究铁粉与水蒸气反应后的产物.(1)探究生成的气体是什么?用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中.说明生成的气体是H2.
(2)探究试管中剩余固体成分是什么?
【查阅资料】
| 常见铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
| 能否被磁铁吸引 | 否 | 否 | 能 |
| 能否与盐酸反应 | 能 | 能 | 能 |
【猜想与假设】猜想一:剩余固体是Fe与Fe3O4;猜想二:剩余固体是Fe3O4.
| 实验操作 | 实验现象及结论 |
| 取少量黑色固体于试管中,加入足量的稀盐酸. | 若固体不溶解,也没有气泡冒出,剩余固体是Fe3O4.若固体部分溶解,有气泡冒出,剩余固体是Fe与Fe3O4. |
6.下列说法中错误的是( )
| A. | 原子核由质子和电子构成 | B. | 化学变化中原子不能再分 | ||
| C. | 分子和原子都在不断运动 | D. | 原子的质量主要集中在原子核上 |
4.下列有关“物质--性质--用途”的叙述中,用途与性质不相关的是( )
| 序号 | 物质 | 性质 | 用途 |
| A | 一氧化碳 | 还原性 | 冶炼金属 |
| B | 氧气 | 助燃性 | 医疗急救 |
| C | 活性炭 | 吸附性 | 防毒面具 |
| D | 干冰 | 蒸发时吸收热量 | 制冷剂 |
| A. | A | B. | B | C. | C | D. | D |
 ”表示有可循环利用的物质)
”表示有可循环利用的物质)