题目内容
15.“对比实验”是化学学习中行之有效的思维方法.请回答下列问题.
(1)实验A:观察到A中①(填“?”或“?)反应更剧烈,可知金属Mg比Zn更活泼.
(2)实验B:烧杯中溶液颜色变化能说明分子不断运动.一段时间后,观察到的主要现象是一段时间后,溶液颜色的变化是红色逐渐变成无色;图2可表示该现象对应反应的微观实质,且甲、乙、丙、丁分别表示NaOH、HCl溶液中的四种离子,乙与丙结合为水的表达式为H++OH-=H2O.
分析 (1)根据金属Mg比Zn的金属活动性顺序进行解答;
(2)根据根据浓盐酸具有挥发性分析溶液的酸碱性及酸碱指示剂颜色的变化,盐酸和NaOH溶液反应生成氯化钠和水进行解答.
解答 解:(1)根据的金属活动性顺序可知:金属Mg比Zn的活动性强,因此反应更剧烈;故填:①;
(2)当烧杯①中液体是浓盐酸,浓盐酸具有挥发性,挥发出的氯化氢气体溶于水显酸性,烧杯②中液体是滴有酚酞的NaOH溶液时,一段时间后,溶液颜色的变化是红色逐渐变成无色;
盐酸与NaOH反应的化学方程式为NaOH+HCl=NaCl+H2O,其中乙和丙是氢氧根离子和氢离子结合产生水,表达式为:H++OH-=H2O;故答案为:一段时间后,溶液颜色的变化是红色逐渐变成无色;H++OH-=H2O.
点评 此题是一道综合性的实验设计题,解题的关键是掌握金属活动性顺序、微粒的性质及中和反应的实质,并进行知识的大胆迁移,只有这样才能顺利解题.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
3.某物质加热分解后有氧气生成,说明该物质中含有( )
| A. | 氧原子 | B. | 氧分子 | C. | 氧元素 | D. | 氧离子 |
10.柴静《雾霾调查:穹顶之下》提到雾霾天气,其主要成因是空气中的烟、灰尘等物质,对人体健康有伤害.下列做法不会加剧雾霾天气形成的是( )
| A. | 燃放鞭炮 | B. | 城市绿化 | C. | 露天焚烧垃圾 | D. | 工厂排放烟尘 |
20.下列物质属于氧化物的是( )
| A. | 液氧 | B. | 水 | C. | 硫酸铜 | D. | 四氧化三铁 |
7.自然界里水的天然循环中没有涉及到的是( )
| A. | 水分子间的间隔 | B. | 水分子的运动 | C. | 水的化学变化 | D. | 水的物理变化 |
5.如图是水分子在一定条件下分解的示意图,从中获得的信息正确的是( )


| A. | 在化学反应中原子的数目一定不变 | |
| B. | 在化学反应中元素的化合价一定不变 | |
| C. | 在化学反应中分子的种类一定不变 | |
| D. | 水的质量与生成氢气和氧气的总质量相等 |

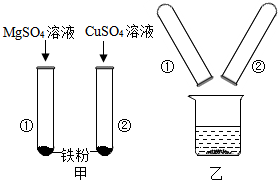 某小组同学在探究Mg、Cu、Fe三种金属的性质时进行了如图所示实验.将实验甲反应后的物质倒入烧杯中,发现烧杯内的红色固体明显增多,充分反应后过滤.下列对滤液溶质可能的组成判断正确的是B(填字母序号)
某小组同学在探究Mg、Cu、Fe三种金属的性质时进行了如图所示实验.将实验甲反应后的物质倒入烧杯中,发现烧杯内的红色固体明显增多,充分反应后过滤.下列对滤液溶质可能的组成判断正确的是B(填字母序号)