题目内容
6. 根据质量守恒定律,回答下列问题.Ⅰ、为验证质量守恒定律,某同学设计了如图的实验.
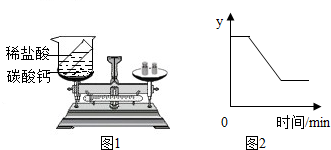
根据质量守恒定律,回答下列问题.Ⅰ、为验证质量守恒定律,某同学设计了如图的实验.(1)该实验的现象是有大量气泡生成、天平指针向右偏转反应的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑.
(2)该实验不能验证质量守恒定律,理由是生成的二氧化碳气体逸散于空气中.
(3)用如图1继续探究质量守恒定律,若药品不变,改进方法是反应在密闭容器中进行,若装置不变,改变药品,可选用的一组药品是硫酸铜溶液与氢氧化钠溶液(举一例).
Ⅱ、用氯酸钾和少量二氧化锰制取氧气的化学方程式为2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,如图2表示一定质量的氯酸钾和二氧化锰固体混合物受热过程中,变量y随时间的变化趋势,则纵坐标y表示的是固体中氧元素的质量.
分析 反应中有气体参与反应,反应前后固体增加的质量即为参加反应的气体的质量,可以据此解答该题.根据盐酸与碳酸钙反应生成了二氧化碳气体,逸散到了空气中会使烧杯中物质的质量减少来分析解答.
解答 解:Ⅰ、(1)碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,该实验的现象是有大量气泡生成、天平指针向右偏转,反应的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑.
(2)生成的二氧化碳气体逸散于空气中,因此反应后观察到天平不平衡,不能验证质量守恒定律;
(3)在反应物不变的前提下,要保持天平平衡,应将反应在密闭容器中进行.装置不变,改变药品,可选用的一组药品是硫酸铜溶液与氢氧化钠溶液,两者反应不生成气体.
故答案为:(1)有大量气泡生成、天平指针向右偏转;Na2CO3+2HCl═2NaCl+H2O+CO2↑;(2)生成的二氧化碳气体逸散于空气中;(3)反应在密闭容器中进行;硫酸铜溶液与氢氧化钠溶液.
Ⅱ、因为氯酸钾在二氧化锰的催化作用下加热会生成氯化钾和氧气,故其化学方程式为:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;氯酸钾加热到一定温度会分解产生氧气,因此固体中的氧元素质量逐渐减小,等到完全分解后保持不变,因此纵坐标y表示的是固体中氧元素的质量.
故答案为:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;固体中氧元素的质量.
故答案为:
(1)有大量气泡生成、天平指针向右偏转;Na2CO3+2HCl═2NaCl+H2O+CO2↑.
(2)生成的二氧化碳气体逸散于空气中.
(3)反应在密闭容器中进行,硫酸铜溶液与氢氧化钠溶液.
Ⅱ、2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,固体中氧元素的质量.
点评 对于质量守恒定律的理解要注意时所用的物质的质量包括气体固体和液体,而气体容易被忽略,所以在设计验证质量守恒的实验时要考虑实验在密闭容器中进行.

 应用题作业本系列答案
应用题作业本系列答案| 实验目的 | 实验方法 | |
| A | 鉴别二氧化碳、氧气和空气 | 将燃着的木条分别伸入瓶中,观察现象 |
| B | 除去CO2 中的少量 CO | 点燃混合气体 |
| C | 除去MnO2中的C | 通过盛有CuO的硬质玻璃管,加热 |
| D | 区分硬水和软水 | 观察颜色 |
| A. | A | B. | B | C. | C | D. | D |
| A. |  氢气验纯 | B. |  闻气体气味 | C. |  检查气密性 | D. |  取固体药品 |
| A. | 铝 | B. | 氧化汞 | C. | 黄铜 | D. | 铁矿石 |
| A. | 双氧水中加入二氧化锰,溶液变蓝 | |
| B. | 氧化铝放入稀盐酸中,产生大量气泡 | |
| C. | 在氢氧化钠稀溶液中滴加数滴硫酸铜溶液,产生蓝色絮状沉淀 | |
| D. | 铵盐与碱溶液混合加热,产生的气体使湿润的蓝色石蕊试纸变红 |
| A. | 五硼烷中含硼元素和氢元素 | |
| B. | 五硼烷的相对分子质量是64g | |
| C. | 五硼烷属于化合物 | |
| D. | 1个五硼烷分子由5个硼原子和9个氢原子构成 |