题目内容
6.绿矾(FeSO4•7H2O)、硫酸亚铁铵[FeSO4•(NH4)2SO4•6H2O]是重要的化工试剂.工业上常利用机械加工行业产生的废铁屑(含有杂质FeS)为原料制备(如图).资料:(1)FeSO4易被氧气氧化为Fe2(SO4)3,影响硫酸亚铁铵的等级.
(2)H2S有毒,水溶液(名称为氢硫酸)显弱酸性.
请回答下列问题:
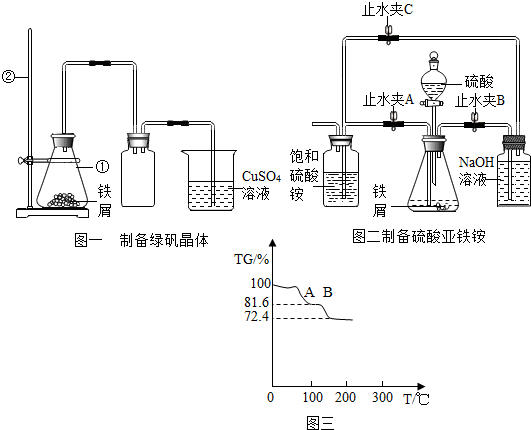
(1)仪器①、②的名称锥形瓶、铁架台.
(2)图一中仪器①盛放的液体是稀硫酸,广口瓶的作用是暂时储存硫化氢气体,烧杯中CuSO4溶液主要作用是吸收H2S,反应为CuSO4+H2S=CuS↓+H2SO4,说明废铁屑中含有FeS杂质,试写出仪器①中产生H2S气体的复分解反应的方程式FeS+H2SO4=FeSO4+H2S↑,烧杯中溶液的pH将随着反应的进行不变(填“增大”、“减小”或“不变”).
(3)图二用于制备硫酸亚铁铵.在0~60℃时,硫酸亚铁铵的溶解度比硫酸铵、硫酸亚铁的小,冷却混合液至室温便析出硫酸亚铁铵.
实验步骤如下:
①制备FeSO4溶液.先关闭止水夹A,再打开止水夹B和C,从分液漏斗滴入稀H2SO4至锥形瓶中,产生的气体依次经过NaOH溶液、饱和硫酸铵溶液.其中NaOH溶液中发生反应的化学方程式为2NaOH+H2S=Na2S+2H2O,氢气的作用是①排尽整个装置中的空气,防止FeSO4被氧化 ②将硫酸亚铁溶液压入饱和碳酸铵溶液.
②待锥形瓶中的铁屑快反应完时,关闭止水夹BC,打开止水夹A.
③放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵晶体.
(4)对所制得的硫酸亚铁铵[FeSO4•(NH4)2SO4•6H2O]样品进行加热分析,温度与TG%的关系如图三所示,已知,200℃以前只有结晶水失去.(FeSO4•(NH4)2SO4•6H2O的相对分子质量:392)
已知:TG%=$\frac{剩余固体质量}{原样品质量}$×100%
TG%从100%降低为72.4%时,发生反应的化学方程式是FeSO4•(NH4)2SO4•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeSO4(NH4)2SO4+6H2O.
试计算AB段物质的化学式FeSO4•(NH4)2SO4(写出计算过程).
分析 (1)根据实验室常用仪器的名称和题中所指仪器的作用进行分析;
(2)根据制备硫酸亚铁铵,需要硫酸亚铁,和硫酸铵,左边的集气瓶中已经有了硫酸铵,需要利用中间的锥形瓶制备硫酸亚铁,需要通过分液漏斗滴加硫酸,稀硫酸和硫化亚铁生成硫酸亚铁和硫化氢,烧杯中的氢离子浓度不变进行分析;
(3)①根据实验操作和注意事项确定氢气和氢氧化钠的作用,氢氧化钠和硫化氢反应生成硫化钠和水进行分析;
②据制备硫酸亚铁铵,需要硫酸亚铁,和硫酸铵,左边的集气瓶中已经有了硫酸铵,需要利用中间的锥形瓶制备硫酸亚铁,需要通过分液漏斗滴加硫酸,结合装置中的反应原理分析关闭和打开活塞的顺序;
(4)根据题中的提示和图象的变化趋势进行分析.对硫酸亚铁铵[FeSO4•(NH4)2SO4•6H2O]样品进行加热到100℃时,首先是固体表面的分子水蒸发得到硫酸亚铁铵[FeSO4•(NH4)2SO4•6H2O],这一步是物理变化,继续加热到100-200℃时,已知200℃以前只有结晶水失去,因此硫酸亚铁铵[FeSO4•(NH4)2SO4•6H2O]中的结晶水开始脱去,这一步是化学变化.
解答 解:(1)通过分析题中所指仪器的作用可知,①是锥形瓶,②是铁架台;
(2)通过分析可知,图一中仪器①盛放的液体是稀硫酸,广口瓶的作用是暂时储存硫化氢,稀硫酸和硫化亚铁生成硫酸亚铁和硫化氢,化学方程式为:FeS+H2SO4=FeSO4+H2S↑,烧杯中的氢离子浓度不变,所以烧杯中溶液的pH将随着反应的进行不变;
(3)①氢氧化钠和硫化氢反应生成硫化钠和水,化学方程式为:2NaOH+H2S=Na2S+2H2O,氢气的作用是:①排尽整个装置中的空气,防止FeSO4被氧化 ②将硫酸亚铁溶液压入饱和碳酸铵溶液;
②待锥形瓶中的铁屑快反应完时,关闭止水夹BC,打开止水夹A;
(4)通过分析可知,对硫酸亚铁铵[FeSO4•(NH4)2SO4•6H2O]样品进行加热到100℃时,首先是固体表面的分子水蒸发得到硫酸亚铁铵[FeSO4•(NH4)2SO4•6H2O],这一步是物理变化,继续加热到100-200℃时,已知200℃以前只有结晶水失去,因此硫酸亚铁铵[FeSO4•(NH4)2SO4•6H2O]中的结晶水开始脱去,这一步是化学变化.
所以TG%从100%降低为72.4%时,发生反应的化学方程式是:FeSO4•(NH4)2SO4•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeSO4(NH4)2SO4+6H2O;
假设硫酸亚铁铵晶体质量是392克,加热到200℃时,失去结晶水,剩下的硫酸亚铁铵质量为:392g×$\frac{284}{392}$=284g,固体质量分数减少为:$\frac{284g}{392g}$×100%=72.4%,所以AB段物质的化学式为:FeSO4•(NH4)2SO4.
故答案为:(1)锥形瓶,铁架台;
(2)稀硫酸,暂时储存硫化氢,FeS+H2SO4=FeSO4+H2S↑,不变;
(3)①2NaOH+H2S=Na2S+2H2O,①排尽整个装置中的空气,防止FeSO4被氧化 ②将硫酸亚铁溶液压入饱和碳酸铵溶液;
②BC,A;
(4)FeSO4•(NH4)2SO4•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeSO4(NH4)2SO4+6H2O;
FeSO4•(NH4)2SO4.
点评 本题的难度比较大,阅读量多,在做这类题时,对题意要理解透,找出有用的物质,然后根据问题结合所学的知识进行解答.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案| A. | 将50.0mL酒精与50.0mL蒸馏水混合,所得溶液体积小于100.0mL | |
| B. | 用托盘天平称取5.62 g 氯化钠固体 | |
| C. | 石蜡在氧气中燃烧时,有水和二氧化碳生成 | |
| D. | 硫在空气中燃烧发出明亮蓝紫色火焰,生成无色无味气体 |
| A. | 食盐(细沙) | B. | 氯化钾(二氧化锰) | C. | 大米(细沙) | D. | 铁粉(硫黄粉) |
| A. | 氯化钠(NaCl2) | B. | 氮气(N2 ) | C. | 水(H2O) | D. | 氧化铝(Al2O3) |
 如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号.下列说法中错误的是( )
如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号.下列说法中错误的是( )| A. | 该实验证明氧气约占空气体积的$\frac{1}{5}$ | |
| B. | 实验时红磷一定要足量 | |
| C. | 在实验过程中,如果红磷伸入太慢的话,会使实验结果比实际值偏小 | |
| D. | 红磷燃烧产生大量的白烟,等火焰熄灭后并冷却后再打开弹簧夹 |
| A. |  加入药品 | B. |  读液体体积 | C. |  检查装置气密性 检查装置气密性 | D. |  氧气验满 |



