题目内容
14.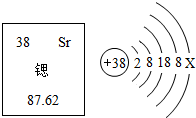 锶元素在元素周期表中的信息与锶原子结构示意图如图所示,下列说法错误的是( )
锶元素在元素周期表中的信息与锶原子结构示意图如图所示,下列说法错误的是( )| A. | Sr为金属元素 | B. | 乙图中X≡3 | ||
| C. | 锶原子的质量为87.62g | D. | 锶原子的质子数是38 |
分析 根据微粒结构示意图的意义以及具体的结构示意图、元素周期表中一个小格表示的意义进行解答即可.
解答 解:A.Sr的元素名称为锶,由偏旁“金”可知,属于金属元素,故正确;
B.在原子结构示意图中,核内质子数=核外电子数,故X=38-2-8-18-8=2,故错误;
C.87.62是锶原子的相对原子质量而不是其实际质量,故错误;
D.原子序数=质子数,锶的原子序数为38,则其质子数为38,故正确.
故选BC.
点评 本题考查了微粒结构示意图和元素周期表的知识,完成此题,可以依据已有的知识进行.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
5.下列实验操作正确的是( )
| A. |  加热胆矾固体 | B. |  稀释浓硫酸 | ||
| C. |  检查装置的气密性 | D. |  滴加液体试剂 |
2. 下表所示实验内容中的横、纵坐标表示的量符合如图所示变化趋势的是( )
下表所示实验内容中的横、纵坐标表示的量符合如图所示变化趋势的是( )
 下表所示实验内容中的横、纵坐标表示的量符合如图所示变化趋势的是( )
下表所示实验内容中的横、纵坐标表示的量符合如图所示变化趋势的是( )| 序号 | 实验内容 | 横坐标表示的量 | 纵坐标表示的量 |
| ① | 饱和氯化钠溶液的稀释 | 加入水的体积 | 溶质质量分数 |
| ② | 过量红磷测定空气中氧气含量 | 时间 | 红磷质量 |
| ③ | 过氧化氢溶液与二氧化锰制氧气 | 时间 | 二氧化锰质量 |
| ④ | 向铜、锌混合物粉末中加入盐酸 | 盐酸质量 | 剩余固体质量 |
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
19.实验设计是化学实验的重要环节.请根据下列实验要求回答相关问题:
【活动与探究一】用对比实验方法探究二氧化碳的性质.
(1)实验一中振荡3个矿泉本塑料瓶,观察到塑料瓶变瘪的程度为A>B>C,其中变浑浊的瓶内发生反应的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O;对比A瓶与C(填“B”或“C”)瓶的实验现象,可证明CO2能与NaOH发生反应.
(2)实验二观察到C装置中发生的现象是干燥的石蕊试纸无变化,湿润的蓝色石蕊试纸变红色结论是CO2+H2O=H2CO3(用化学方程式表示).
【活动与探究二】用变量控制方法探究影响物质溶解性的因素.
(3)实验三目的是探究温度对硝酸钾溶解性的影响;实验四是探究溶剂种类对物质溶解性的影响,该实验中需要控制的变量是温度和溶质、溶剂的质量相等.
(4)实验五中,反应的原理为2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO(用化学方程式表示);装置一比装置二更合理,理由是装置一中氧气反应的更充分;
根据下表提供的实验数据,完成如表:
定量实验操作中易产生误差,如果反应前气球中存在气体(其量小于注射器内的空气),而实验后冷却至室温,将气球内的气体全部挤出读数,导致实验测得结果偏小(填“偏小、‘偏大”或“无影响”).
| 实验一 | 实验二 |
 |  |
(1)实验一中振荡3个矿泉本塑料瓶,观察到塑料瓶变瘪的程度为A>B>C,其中变浑浊的瓶内发生反应的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O;对比A瓶与C(填“B”或“C”)瓶的实验现象,可证明CO2能与NaOH发生反应.
(2)实验二观察到C装置中发生的现象是干燥的石蕊试纸无变化,湿润的蓝色石蕊试纸变红色结论是CO2+H2O=H2CO3(用化学方程式表示).
【活动与探究二】用变量控制方法探究影响物质溶解性的因素.
| 实验三 | 实验四 |
 |  |
(4)实验五中,反应的原理为2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO(用化学方程式表示);装置一比装置二更合理,理由是装置一中氧气反应的更充分;
根据下表提供的实验数据,完成如表:
| 硬质玻璃管的容积 | 反应前注射器中气体体积 | 反应后注射器中气体体积 | 实验测得空气中氧气的体积分数 |
| 30mL | 20mL | 12mL |
| 实验五 | |
 |  |
3.比较、推理是化学学习常用的方法.以下推理不合理的是( )
| 序号 | 化学反应事实 | 影响反应的因素 |
| A | 二氧化碳常温下与水反应,生成碳酸,光合作用时则生成葡萄糖 | 反应条件 |
| B | 碳在常温下不与氧气反应,而在点燃时能与氧气反应 | 反应温度 |
| C | 双氧水在常温下较难分解,而在加入二氧化锰后迅速分解 | 催化剂 |
| D | 铜片在空气中很难燃烧,铜粉在空气中较易燃烧 | 反应物的种类 |
| A. | A | B. | B | C. | C | D. | D |
 有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.取样溶解于水,有白色沉淀产生;过滤后,向该白色沉淀中滴加盐酸,现象如图所示(ABC表示沉淀变化,OBC表示气体变化).
有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.取样溶解于水,有白色沉淀产生;过滤后,向该白色沉淀中滴加盐酸,现象如图所示(ABC表示沉淀变化,OBC表示气体变化).