题目内容
氯化铁是一种重要的铁盐,广泛用于造纸、印染等污染处理.
【物质制备】某兴趣小组同学查找到以黄铁矿(主要成分是二硫化亚铁,化学式为FeS2)为主要原料制备氯化铁晶体的工业生产过程:
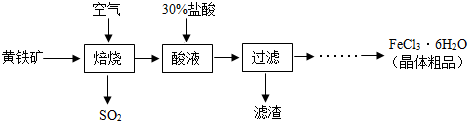
(1)黄铁矿是 物(填“纯净”或“混合”),其中二硫化亚铁中铁元素的化合价为 .
(2)焙烧过程主要发生以下化学反应,配平化学方程式:FeS2+O2
Fe2O3+SO2
【含量测定】(3)该过程产生的尾气中含有HCl等气体,可用 溶液来吸收(填化学式).
在上述流程中产生的SO2气体可用于工业上生产硫酸,该兴趣小组的同学为测定某黄铁矿中硫元素的含量进行了如下的实验探究.
已知亚硫酸钠与过氧化氢反应能生成硫酸钠和水.(假设每步反应均完全,不考虑装置内原有空气对测定结果的影响)
甲、乙二个实验小组均设计了下列装置,称取了m1g黄铁矿样品,将样品放入如图所示的硬质粗玻璃管中,从a处不断地缓缓通入空气,高温灼烧玻璃管中的黄铁矿样品至反应完全.
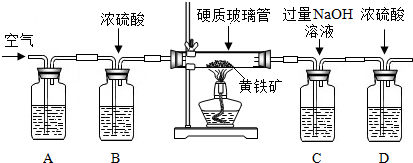
甲组同学仅称量了上述实验所需要的相关装置质量后即完成了测定.
乙组同学则在上述反应结束后,将C瓶中的溶液进行了如图的处理: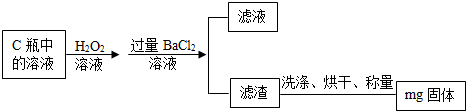
问题讨论:
(4)上述装置中A瓶内所盛的试剂最好是 溶液,其作用是 .A、B装置能否对调位置 ?(填“能”或“否”)
(5)气体进入C瓶后,C瓶中发生反应的化学方程式为 ,该反应是否属于基本反应类型 (填“是”或“否”).
(6)甲组同学应称量的数据是 (填编号).
①反应前C装置及其中物质总质量m2g
②反应前C、D装置及其中物质总质量m3g
③反应后C装置及其中物质总质量m4g
④反应后C、D装置及其中物质总质量m5g
(7)根据(6)中所选数据,甲组同学测得的该黄铁矿中硫元素的质量分数的表达式为 .
(8)乙组同学最终得到的固体的化学式为,检验所加BaCl2溶液是否过量的方法是,乙组的实验过程中洗涤滤渣的目的是,若未洗涤就直接烘干称量,则会使测定结果 (填“偏大、偏小或不变”),检验滤渣是否洗净所用试剂是 溶液,该小组测定的硫元素的质量分数的表达式为 .
【物质制备】某兴趣小组同学查找到以黄铁矿(主要成分是二硫化亚铁,化学式为FeS2)为主要原料制备氯化铁晶体的工业生产过程:

(1)黄铁矿是
(2)焙烧过程主要发生以下化学反应,配平化学方程式:FeS2+O2
| ||
【含量测定】(3)该过程产生的尾气中含有HCl等气体,可用
在上述流程中产生的SO2气体可用于工业上生产硫酸,该兴趣小组的同学为测定某黄铁矿中硫元素的含量进行了如下的实验探究.
已知亚硫酸钠与过氧化氢反应能生成硫酸钠和水.(假设每步反应均完全,不考虑装置内原有空气对测定结果的影响)
甲、乙二个实验小组均设计了下列装置,称取了m1g黄铁矿样品,将样品放入如图所示的硬质粗玻璃管中,从a处不断地缓缓通入空气,高温灼烧玻璃管中的黄铁矿样品至反应完全.

甲组同学仅称量了上述实验所需要的相关装置质量后即完成了测定.
乙组同学则在上述反应结束后,将C瓶中的溶液进行了如图的处理:

问题讨论:
(4)上述装置中A瓶内所盛的试剂最好是
(5)气体进入C瓶后,C瓶中发生反应的化学方程式为
(6)甲组同学应称量的数据是
①反应前C装置及其中物质总质量m2g
②反应前C、D装置及其中物质总质量m3g
③反应后C装置及其中物质总质量m4g
④反应后C、D装置及其中物质总质量m5g
(7)根据(6)中所选数据,甲组同学测得的该黄铁矿中硫元素的质量分数的表达式为
(8)乙组同学最终得到的固体的化学式为,检验所加BaCl2溶液是否过量的方法是,乙组的实验过程中洗涤滤渣的目的是,若未洗涤就直接烘干称量,则会使测定结果
考点:物质的相互转化和制备,常见气体的检验与除杂方法,有关元素化合价的计算,反应类型的判定,化学方程式的配平,书写化学方程式、文字表达式、电离方程式
专题:物质的制备
分析:(1)根据黄铁矿的主要成分是二硫化亚铁,二硫化亚铁中的铁是亚铁进行分析;
(2)根据质量守恒定律进行分析;
(3)根据酸性气体可以用碱性液体来吸收进行分析;
(4)根据A瓶的作用是除去空气中的二氧化碳进行分析;
(5)根据二氧化硫和氢氧化钠反应会生成亚硫酸钠和水,以及化学反应基本类型满足的条件进行分析;
(6)根据C、D中增加的质量是反应生成的二氧化硫,然后结合样品的质量即可求出硫元素的质量分数进行分析;
(7)根据二氧化硫中硫元素的质量分数可以计算生成的二氧化硫中硫的质量,再计算黄铁矿中硫元素的质量分数;
(8)根据过氧化氢有强氧化性,会将亚硫酸钠氧化成硫酸钠,硫酸钠和氯化钡会生成硫酸钡沉淀,再根据硫原子守恒计算硫铁矿中硫的质量,从而计算其质量分数.
(2)根据质量守恒定律进行分析;
(3)根据酸性气体可以用碱性液体来吸收进行分析;
(4)根据A瓶的作用是除去空气中的二氧化碳进行分析;
(5)根据二氧化硫和氢氧化钠反应会生成亚硫酸钠和水,以及化学反应基本类型满足的条件进行分析;
(6)根据C、D中增加的质量是反应生成的二氧化硫,然后结合样品的质量即可求出硫元素的质量分数进行分析;
(7)根据二氧化硫中硫元素的质量分数可以计算生成的二氧化硫中硫的质量,再计算黄铁矿中硫元素的质量分数;
(8)根据过氧化氢有强氧化性,会将亚硫酸钠氧化成硫酸钠,硫酸钠和氯化钡会生成硫酸钡沉淀,再根据硫原子守恒计算硫铁矿中硫的质量,从而计算其质量分数.
解答:解:(1)黄铁矿的主要成分是二硫化亚铁,所以黄铁矿是混合物,FeS2名称为二硫化亚铁中铁元素是亚铁,所以铁元素的化合价是+2价;
(2)通过质量守恒定律可知,在化学反应前后,原子的数目不变,所以经过配平后的方程式为:4FeS2+11O2
2Fe2O3+8SO2;
(3)尾气中含有HCl等气体,可用碱性液体吸收,如NaOH;
(4)通过分析可知,A瓶的作用是除去空气中的二氧化碳,可以是氢氧化钠溶液,A、B不能颠倒,否则不能将二氧化碳和水蒸气除去,对后面的实验结果造成影响;
(5)二氧化硫和氢氧化钠反应会生成亚硫酸钠和水,化学方程式为:SO2+2NaOH=Na2SO3+H2O,该反应不满足四种化学反应基本类型的条件,不属于反应基本类型;
(6)通过分析可知,C、D中增加的质量是反应生成的二氧化硫,知道了二氧化硫的质量,再结合样品的质量即可求出硫元素的质量分数,所以应称量的数据是:②④;
(7)二氧化硫中硫元素的质量分数为:50%,所以根据(6)中所选数据,甲组同学测得的该黄铁矿中硫元素的质量分数的表达式为:
;
(8)过氧化氢有强氧化性,会将亚硫酸钠氧化成硫酸钠,硫酸钠和氯化钡会生成硫酸钡沉淀,所以乙组同学最终得到的固体的化学式为:BaSO4,检验所加BaCl2溶液是否过量的方法是:静置,在上层清液再加氯化钡溶液,若无沉淀产生,则已过量,乙组的实验过程中洗涤滤渣的目的是:除去沉淀表面的可溶性杂质,若未洗涤就直接烘干称量,则会使测定结果偏大,检验滤渣是否洗净所用试剂是硝酸银溶液,硫原子守恒计算硫铁矿中硫的质量,所以该小组测定的硫元素的质量分数的表达式为:
.
故答案为:(1)混合,+2;
(2)4 11 2 8;
(3)NaOH;
(4)NaOH,吸收空气中的CO2,否;
(5)SO2+2NaOH=Na2SO3+H2O,否;
(6)②④;
(7)
;
(8)BaSO4,静置,在上层清液再加氯化钡溶液,若无沉淀产生,则已过量;除去沉淀表面的可溶性杂质,大,硝酸银,
.
(2)通过质量守恒定律可知,在化学反应前后,原子的数目不变,所以经过配平后的方程式为:4FeS2+11O2
| ||
(3)尾气中含有HCl等气体,可用碱性液体吸收,如NaOH;
(4)通过分析可知,A瓶的作用是除去空气中的二氧化碳,可以是氢氧化钠溶液,A、B不能颠倒,否则不能将二氧化碳和水蒸气除去,对后面的实验结果造成影响;
(5)二氧化硫和氢氧化钠反应会生成亚硫酸钠和水,化学方程式为:SO2+2NaOH=Na2SO3+H2O,该反应不满足四种化学反应基本类型的条件,不属于反应基本类型;
(6)通过分析可知,C、D中增加的质量是反应生成的二氧化硫,知道了二氧化硫的质量,再结合样品的质量即可求出硫元素的质量分数,所以应称量的数据是:②④;
(7)二氧化硫中硫元素的质量分数为:50%,所以根据(6)中所选数据,甲组同学测得的该黄铁矿中硫元素的质量分数的表达式为:
| m5-m3 |
| 2m1 |
(8)过氧化氢有强氧化性,会将亚硫酸钠氧化成硫酸钠,硫酸钠和氯化钡会生成硫酸钡沉淀,所以乙组同学最终得到的固体的化学式为:BaSO4,检验所加BaCl2溶液是否过量的方法是:静置,在上层清液再加氯化钡溶液,若无沉淀产生,则已过量,乙组的实验过程中洗涤滤渣的目的是:除去沉淀表面的可溶性杂质,若未洗涤就直接烘干称量,则会使测定结果偏大,检验滤渣是否洗净所用试剂是硝酸银溶液,硫原子守恒计算硫铁矿中硫的质量,所以该小组测定的硫元素的质量分数的表达式为:
| 32m6 |
| 233m1 |
故答案为:(1)混合,+2;
(2)4 11 2 8;
(3)NaOH;
(4)NaOH,吸收空气中的CO2,否;
(5)SO2+2NaOH=Na2SO3+H2O,否;
(6)②④;
(7)
| m5-m3 |
| 2m1 |
(8)BaSO4,静置,在上层清液再加氯化钡溶液,若无沉淀产生,则已过量;除去沉淀表面的可溶性杂质,大,硝酸银,
| 32m6 |
| 233m1 |
点评:本题考查物质成分和含量的测定,涉及仪器选用、误差分析、质量分数计算等知识,具有较强的综合性,解题时注意从质量守恒的角度分析,本题难度中等.

练习册系列答案
相关题目
下列反应属于化合反应的是( )
A、过氧化氢
| ||
B、石蜡+氧气
| ||
C、铁+氧气
| ||
D、氧化汞
|
关于Fe、Fe2+、Fe3+的说法中,正确的是( )
| A、他们结合其他原子的个数相同 |
| B、他们的质子数相同 |
| C、他们的最外层电子数相同 |
| D、他们的核外电子数相同 |
下列关于H2、H2S、NH3、H2CO3四种物质的叙述中正确的是( )
| A、氢元素都以化合物形式存在 |
| B、氢元素的化合价都相同 |
| C、都含有氢分子 |
| D、都含有氢元素 |
下列说法不正确的是( )
| A、酸和碱都一定含有氢元素 |
| B、pH大于7的溶液一定是碱的水溶液 |
| C、硫酸在水中电离出氢离子和硫酸根离子,其水溶液呈电中性 |
| D、硫酸根离子不具有酸性 |