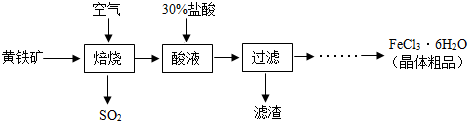
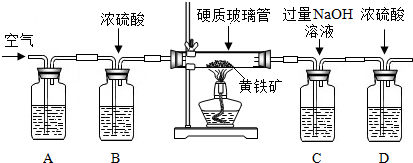
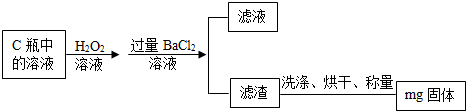
题目内容
关于Fe、Fe2+、Fe3+的说法中,正确的是( )
| A、他们结合其他原子的个数相同 |
| B、他们的质子数相同 |
| C、他们的最外层电子数相同 |
| D、他们的核外电子数相同 |
考点:原子和离子的相互转化
专题:物质的微观构成与物质的宏观组成
分析:根据Fe、Fe2+、Fe3+三种粒子可以看出它们都是铁元素形成的不同微粒,则它们的质子数相同,它们的电子数不同,化学性质不同.
解答:解:
A、因Fe、Fe2+、Fe3+三种粒子的核外电子数不同,最外层电子数也不同,所以化合价不同,则结合其他原子的个数不同,说法错误;
B、它们是同种元素形成的微粒,核电荷数相同,则质子数相同,说法正确;
C、因金属原子失去电子变为金属阳离子,且Fe2+、Fe3+带电荷不同,则原子变为离子失去的电子数不同,则它们的最外层电子数不相同,说法错误;
D、由C分析可知:原子变为离子失去的电子数不同,则三种粒子的核外电子数不同,说法错误;
故选:B.
A、因Fe、Fe2+、Fe3+三种粒子的核外电子数不同,最外层电子数也不同,所以化合价不同,则结合其他原子的个数不同,说法错误;
B、它们是同种元素形成的微粒,核电荷数相同,则质子数相同,说法正确;
C、因金属原子失去电子变为金属阳离子,且Fe2+、Fe3+带电荷不同,则原子变为离子失去的电子数不同,则它们的最外层电子数不相同,说法错误;
D、由C分析可知:原子变为离子失去的电子数不同,则三种粒子的核外电子数不同,说法错误;
故选:B.
点评:本题考查原子和离子的相互转化,学生应注意单原子形成的微粒中质子数与电子数的关系,这是解题的关键.

练习册系列答案
相关题目
某同学在学完《分子和原子》后,采用如图探究分子运动现象,下列说法错误的是( )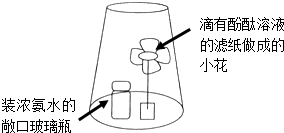

| A、浓氨水有挥发性 |
| B、图中小花上滴有酚酞的地方变红 |
| C、分子不断地运动 |
| D、瓶中浓氨水变红 |
阴离子R2-中含有18个电子,R的相对原子质量为32,则一个R原子中所含中子数为( )
| A、20 | B、12 | C、16 | D、18 |