题目内容
20.10克镁铝合金与足量稀硫酸充分反应后生成1克氢气,则合金中镁铝的质量比为( )| A. | 2:1 | B. | 3:2 | C. | 2:3 | D. | 1:2 |
分析 发生反应:Mg+H2SO4=MgSO4+H2↑、2Al+2H2SO4=Al2(SO4)3+3H2↑,设Mg的物质的质量为x,Al的物质的质量为y,表示出各自生成氢气的物质的质量,再列方程解答.
解答 解:设Mg的物质的质量为x,Al的物质的质量为y,有:
Mg+H2SO4=MgSO4+H2↑
24 2
x $\frac{x}{12}$
2Al+2H2SO4=Al2(SO4)3+3H2↑
54 6
y $\frac{y}{9}$
由题意可知:$\left\{\begin{array}{l}{x+y=10g}\\{\frac{x}{12}+\frac{y}{9}=1g}\end{array}\right.$
解得x=4g,y=6g,
则合金中镁铝的质量比为4g:6g=2:3.
故选:C.
点评 本题考查化学方程式计算、混合物计算,比较基础,有利于基础知识的巩固.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
8.生活离不开化学.某综合实践活动小组在调查市场时发现下列一些现象,并提出了整改建议.你认为所提建议中,不安全或违法的是( )
| A. | 海鲜在夏天容易腐烂变质:建议用福尔马林(甲醛溶液)浸泡海鲜防腐 | |
| B. | 海鲜在夏天容易窝烂变质:建议将海鲜真空包装后速冻冷藏保鲜 | |
| C. | 大米保存不当易发霉、生虫:建议将其低温、干燥贮存 | |
| D. | 蔬菜汁饼干易氧化变质:建议包装饼干时加入铁粉作抗氧化剂和吸水剂并密封 |
15.配制一定质量分数的NaCl溶液时,会引起溶质质量分数偏小的操作是( )
| A. | 称量完固体NaCl时,天平的指针向左倾斜 | |
| B. | 实验所用的NaCl已在空气中久置 | |
| C. | 用量筒量取水时俯视读数 | |
| D. | 将已配制好的NaCl溶液装入试剂瓶时,有少量溶液洒在瓶外 |
9.下列关于水的说法不正确的是( )
| A. | 水是常用来溶解其它物质 | B. | 自然界中的水都是混合物 | ||
| C. | 过滤可以除去天然水中的各种杂质 | D. | 长期饮用蒸馏水无益于人体的健康 |
10.下列各组物质,只用一种试剂(括号内物质)及相互之间的反应不能鉴别开来的是( )
| A. | 固体:食盐、硝酸铵、烧碱 (水) | |
| B. | 固体:硫酸铜、熟石灰、碳酸钙(稀盐酸) | |
| C. | 溶液:纯碱、食盐、盐酸 (酚酞试液) | |
| D. | 溶液:氯化钠、氯化钾、硫酸钾(硝酸银溶液) |
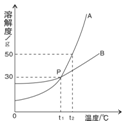 根据如图中a、b两种物质的溶解度曲线,回答下列问题:
根据如图中a、b两种物质的溶解度曲线,回答下列问题: