题目内容
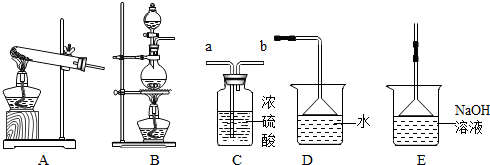
13.如图所示为实验室中常见气体的制备、干燥、收集和性质实验的部分仪器,某校化学兴趣小组的同学欲用它们完成如下探究实验.试根据题目要求回答下列问题: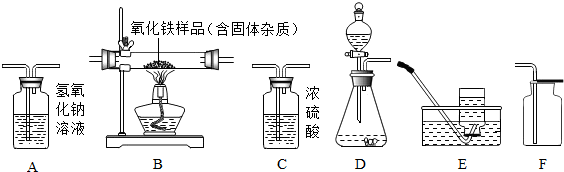
(1)在实验室中,若以过氧化氢溶液为原料(二氧化锰作催化剂),制备并收集一瓶干燥的氧气.
①所选仪器的连接顺序为A→D→F(填写仪器序号字母).
②制取氧气的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
③用排空气法收集气体时,检验集气瓶内收集满氧气的方法是拿一根带火星的木条放在集气瓶口,若木条复燃,则证明集气瓶内已充满氧气.
(2)用一氧化碳气体(含少量二氧化碳)测定质量为Wg的某氧化铁样品中含Fe2O3的质量分数(假设杂质不挥发,也不发生反应).所选仪器的连接顺序为:混合气体→A1→C→B→A2.试回答下列问题:(假设过程中氧化铁全部参加反应;仪器A1、A2 和C吸收气体完全).
①仪器C的作用是吸收水分(或干燥一氧化碳气体).
②实验中,欲通过测量反应前后盛有氢氧化钠溶液洗气瓶的质量变化,来计算氧化铁样品中含Fe2O3的质量分数.若测得仪器A1的质量增加m g,仪器A2的质量增加n g,则该氧化铁样品中含Fe2O3的质量分数是$\frac{40n}{33W}$×100%(计算结果可为分数形式).
③实验过程中,在其他操作正常的条件下,欲通过测量反应前后B处大玻璃管的质量变化,来计算氧化铁样品中含Fe2O3的质量分数.若不连接仪器A1,则测算结果与实际值相比较将偏大(填“偏小”“偏大”“不受影响”之一).
④对于该实验方案设计还存在不完善之处,你的具体改进方案是装置末端加一只燃着的酒精灯,处理尾气.
分析 (1)根据实验室制备氧气的实验步骤、原理以及注意事项进行解答;
(2)A2处放的是氢氧化钠溶液,可与一氧化碳和氧化铁反应生成的二氧化碳充分反应,故该装置增加的质量即是反应生成的二氧化碳的质量,然后结合一氧化碳和氧化铁反应的方程式计算出参加反应的氧化铁的质量,据氧化铁的质量分数计算即可;若上述连接仪器没有使用A1装置,则A2装置增重的质量既包括反应生成的二氧化碳,还包括本来就有的二氧化碳,会使计算的氧化铁的质量增加,纯度比实际值偏大.
解答 解:(1)①由过氧化氢溶液和二氧化锰为原料在实验室中制备并收集干燥的氧气实验步骤可知:所选仪器的连接顺序为A→D→F;
②所发生反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
③用排空气法收集气体时,检验集气瓶内收集满氧气的方法是拿一根带火星的木条放在集气瓶口,若木条复燃,则证明集气瓶内已充满氧气;
(2))①欲用一氧化碳气体(含少量二氧化碳气体)测定某不纯氧化铁样品的纯度(杂质不参与任何反应),并验证反应中气体生成物的性质,则须先除去二氧化碳,避免干扰,除去二氧化碳用氢氧化钠溶液;
A2处放的是氢氧化钠溶液,可与一氧化碳和氧化铁反应生成的二氧化碳充分反应,故该装置增加的质量即是反应生成的二氧化碳的质量;
设样品中氧化铁的质量为x
Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
160 132
x ng
$\frac{160}{x}=\frac{132}{ng}$
x=$\frac{40n}{33}$g
该氧化铁样品中含Fe2O3的质量分数是$\frac{\frac{40n}{33}g}{Wg}×$100%=$\frac{40n}{33W}$×100%;
③若上述连接仪器没有使用A1装置,则A2装置增重的质量既包括反应生成的二氧化碳,还包括本来就有的二氧化碳,会使计算的氧化铁的质量增加,纯度比实际值偏大;
④对于该实验方案设计还存在不完善之处,具体改进方案是装置末端加一只燃着的酒精灯,处理尾气.
答案:
(1)①D→C→F;
②2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
③拿一根带火星的木条放在集气瓶口,若木条复燃,则证明集气瓶内已充满氧气.
(2)①吸收水分(或干燥一氧化碳气体);
②$\frac{40n}{33W}$×100%;
③偏大;
④装置末端加一只燃着的酒精灯,处理尾气.
点评 本题综合考查了常见的气体制备、干燥、净化和收集实验,一氧化碳还原氧化铁的化学反应以及相关知识的考查,要结合所学知识细心解答.

| 样品 | 第1份 | 第2份 | 第3份 | 第4份 |
| 取样品的质量(g) | 50.0 | 50.0 | 50.0 | 50.0 |
| 加稀硫酸的质量(g) | 40.0 | 80.0 | 120.0 | 160.0 |
| 剩余物的质量(g) | 89.6 | 129.2 | 169 | 209 |
(1)经分析,在第1份样品测得的数据中,硫酸(填物质)完全反应了.
(2)列式计算黄铜屑样品中的锌的质量分数.
(3)请计算出第3次入稀硫酸后所得溶液中硫酸锌的质量分数?
| A. | 工业上常用稀硫酸除去铁锈,是因为稀硫酸能与三氧化二铁反应 | |
| B. | 洗涤剂常用来去除油污,是因为洗涤剂具有乳化作用 | |
| C. | 氢氧化钙可用来改良酸性土壤,是因为氢氧化钙溶液呈碱性 | |
| D. | 液氧可用于火箭发射,是因为液氧具有可燃性 |
Ⅰ.取少量固体于烧杯中,逐渐加水并不断搅拌至烧杯内固体不再溶解;
Ⅱ.过滤,得到白色固体和无色清液.
Ⅲ.取少量清液于试管中,滴加酚酞溶液,酚酞溶液不变色;
请回答下列问题:
(1)根据上述信息判断,该样品不可能含硫酸铜和氢氧化钠固体.
(2)提出合理假设.样品的成分有3种可能:
假设1:碳酸钠、硝酸钡; 假设2:硫酸钠、硝酸钡
假设3:碳酸钠、硫酸钠、硝酸钡.
(3)为进一步探究固体样品的成分,该组同学取少量原固体样品于试管中.
限选试剂:稀HCl、稀H2SO4、稀HNO3溶液、BaCl2溶液、蒸馏水
完成实验方案.请填写实验操作、与表中结论相符的预期现象.
| 实验操作 | 预期现象 | 结论 |
| 步骤1:取少量原固体样品于试管中,逐渐加水并不断搅拌至烧杯内固体不再溶解 | 有白色固体 | 假设1成立. |
| 步骤2:向步骤1反应后的白色固体中滴加足量稀稀HNO3溶液,并不断震荡 | 白色固体完全溶解,有气泡产生 |
| A. | 能使紫色石蕊溶液变红色 | B. | 能与氢氧化钠反应生成水 | ||
| C. | 能与铝粉反应生成氢气 | D. | 能与二氧化碳反应生成水 |