题目内容
8.我们已经学过氢气、氧气、二氧化碳等气体的制备方法和化学性质.以下是实验室制备、洗涤、干燥气体及进行尾气处理的常见仪器装置.请结合所学知识回答下列问题:氯气的资料:氯气溶入水显酸性,氯气能和碱性溶液反应,且氯气有毒,并有剧烈的刺激性,若吸入大量氯气,可中毒死亡,所以氯气直接排入大气中,会污染环境.
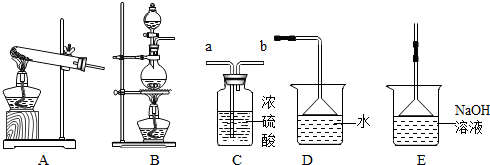
(1)下列气体中,只能用碱石灰干燥的是D(填字母).
A.H2 B.Cl2 C.SO2 D.NH3 E.O2
(2)实验室用软锰矿(主要成分是MnO2)与浓盐酸混合加热制得氯气,所选制备装置是B,干燥氯气的装置是C,尾气处理装置是E.
(3)实验室用氯化铵和熟石灰制取氨气,其化学反应方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
分析 氢气和氧气既能用浓硫酸干燥又能用碱石灰干燥,Cl2和SO2只能用浓硫酸干燥,不能用碱石灰干燥;NH3只能用碱石灰干燥,不能用浓硫酸干燥;制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,实验室用软锰矿(主要成分是MnO2)与浓盐酸混合加热制得氯气,所选制备装置是B,氯气可以用浓硫酸干燥,可以用氢氧化钠溶液吸收,防止污染空气;氯化铵和熟石灰在加热的条件下生成氯化钙和水和氨气,配平即可.
解答 解:(1)氢气和氧气既能用浓硫酸干燥又能用碱石灰干燥,Cl2和SO2只能用浓硫酸干燥,不能用碱石灰干燥;NH3只能用碱石灰干燥,不能用浓硫酸干燥;故答案为:D;
(2)实验室用软锰矿(主要成分是MnO2)与浓盐酸混合加热制得氯气,所选制备装置是B,氯气可以用浓硫酸干燥,可以用氢氧化钠溶液吸收,防止污染空气;故答案为:B;C;E;
(3)氯化铵和熟石灰在加热的条件下生成氯化钙和水和氨气,配平即可;故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;
点评 本考点主要考查了气体的干燥、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
20. 如图是元素周期表中汞元素的相关信息,下列说法错误的是( )
如图是元素周期表中汞元素的相关信息,下列说法错误的是( )
 如图是元素周期表中汞元素的相关信息,下列说法错误的是( )
如图是元素周期表中汞元素的相关信息,下列说法错误的是( )| A. | 汞属于非金属元素 | B. | 汞的原子序数是80 | ||
| C. | 汞原子的质子数是80 | D. | 汞的相对原子质量是200.6 |
17.下列各组物质的鉴别方法中不正确的是( )
| A. | 用灼烧的方法鉴别羊毛和合成纤维 | |
| B. | 用盐酸鉴别氢氧化钠是否变质 | |
| C. | 用石灰水区别氧气和二氧化碳 | |
| D. | 用观察颜色的方法鉴别氧化铜和四氧化三铁 |

 如图是测定空气中氧气含量实验的改进装置.
如图是测定空气中氧气含量实验的改进装置.
 测定空气中氧气含量的实验中,某间学发观,实验结束后,将塞子取下,燃烧匙取出后,匙内的红磷重新燃烧起来,造成室内污染.
测定空气中氧气含量的实验中,某间学发观,实验结束后,将塞子取下,燃烧匙取出后,匙内的红磷重新燃烧起来,造成室内污染.