题目内容
14. 用如图所示装置,在常温下,分别进行研究燃烧条件和研究氧气性质的实验.已知:白磷的着火点为40℃.
用如图所示装置,在常温下,分别进行研究燃烧条件和研究氧气性质的实验.已知:白磷的着火点为40℃.| 内容步骤 | 【实验1】研究燃烧条件 | 【实验2】研究氧气性质 |
Ⅰ | 烧杯中盛有80℃的热水,分别在燃烧匙和烧杯中导管口放置一小块白磷,塞紧瓶塞 | 烧杯中盛有NaOH溶液,燃烧匙中放入木炭 点燃木炭后,迅速将燃烧匙伸入瓶中,塞紧瓶塞 |
| Ⅱ | 推入适量H2O2 溶液 | 推入适量H2O2 溶液 |
(2)实验1中,推入H2O2溶液前,燃烧匙和水中的白磷均没燃烧,燃烧匙中白磷没燃烧是因为未达到白磷的着火点,水中的白磷没燃烧是因为没有与O2接触; 推入H2O2溶液后,观察到烧杯中的现象是导管口有气泡冒出,白磷燃烧;
(3)实验2中,推入H2O2溶液后,观察到木炭燃烧得更剧烈,由此得出氧气的性质是助燃性;木炭熄灭后冷却一段时间,烧杯中的部分溶液流入集气瓶.在实验2的整个过程中,集气瓶内压强的变化过程是先增大后减小.
分析 (1)H2O2稀溶液与MnO2接触时生成水和氧气;
(2)根据燃烧的条件分析;燃烧的条件是:物质具有可燃性、与氧气接触、达到着火点;
(3)根据信息:推入H2O2溶液后,观察到木炭燃烧得更剧烈,分析解答.
解答 解:
(1)H2O2稀溶液与MnO2接触时生成水和氧气,反应的方程式是:2H2O2$\frac{\underline{\;\;△\;\;}}{\;}$ 2H2O+O2↑;
(2)根据燃烧的条件可知,燃烧匙中白磷不燃烧是因为未达到白磷的着火点,烧杯中白磷未燃烧是因为没有与O2接触;推入H2O2溶液后,生成氧气,氧气通过导管进入烧杯,所以观察到烧杯中的现象是导管口有气泡冒出;
(3)实验2中,推入H2O2溶液后,观察到木炭燃烧得更剧烈,由此得出氧气的性质是助燃;木炭熄灭后冷却一段时间,烧杯中的部分溶液流入集气瓶.该实验中,集气瓶内压强的变化过程是,先增大后减小,最后回复止常压.
故答案为:
(1)2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$ 2H2O+O2↑;
(2)未达到白磷的着火点;没有与O2接触;导管口有气泡冒出,白磷燃烧;
(3)助燃性;先增大后减小.
点评 此题考查燃烧的条件、化学方程式的书写、压强的变化等知识,有一定的难度.燃烧的条件分析;燃烧的条件是:物质具有可燃性、与氧气接触、达到着火点.

练习册系列答案
 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
5.某学校化学兴趣小组的同学对我市南部山区的大理石矿区进行调查并取样.样品的主要成分是碳酸钙(其中含有二氧化硅等杂质).下面是同学们的实验探究过程,请你参与并回答有关.
【实验目的】测定大理石样品中碳酸钙的质量分数.
【查阅资料】二氧化硅等杂质不溶于水,也不与盐酸反应.
【实验过程】准确称量5.0g大理石样品于烧杯中,向其中加入40mL质量分数为20%的盐酸,立即将烧杯放在电子秤上称量.每分钟记录一次数据(提示:反应结束后盐酸有剩余).
相关的实验数据如下表:
【数据处理】
(1)表中有一个称量数据是不合理的,该数据的测定时间是5分钟.
(2)计算样品中碳酸钙的质量分数.(写出计算过程,计算结果保留一位小数)
【反思交流】实验结束后,部分同学认为测得的碳酸钙质量分数偏大,请你分析出现此情况的原因可能是烧杯减少的质量除二氧化碳外还含有盐酸挥发出的氯化氢气体.
【实验目的】测定大理石样品中碳酸钙的质量分数.
【查阅资料】二氧化硅等杂质不溶于水,也不与盐酸反应.
【实验过程】准确称量5.0g大理石样品于烧杯中,向其中加入40mL质量分数为20%的盐酸,立即将烧杯放在电子秤上称量.每分钟记录一次数据(提示:反应结束后盐酸有剩余).
相关的实验数据如下表:
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 质量/g | 102.0 | 101.0 | 100.5 | 100.2 | 100.1 | 100.4 | 100.1 | 100.1 | 100.1 |
(1)表中有一个称量数据是不合理的,该数据的测定时间是5分钟.
(2)计算样品中碳酸钙的质量分数.(写出计算过程,计算结果保留一位小数)
【反思交流】实验结束后,部分同学认为测得的碳酸钙质量分数偏大,请你分析出现此情况的原因可能是烧杯减少的质量除二氧化碳外还含有盐酸挥发出的氯化氢气体.
9.下列物质中富含蛋白质的有( )
| A. |  米饭和馒头 | B. |  大豆油和花生 | C. |  瘦肉和鸡蛋 | D. |  蔬菜和水果 |
6.洁净的空气对人类的健康是非常重要的,下列影响空气质量的一组主要污染物是( )
| A. | 二氧化硫 二氧化氮 二氧化碳 | B. | 二氧化硫 二氧化氮 一氧化碳 | ||
| C. | 二氧化碳 氮气 稀有气体 | D. | 一氧化碳 氧气 可吸入颗粒物 |
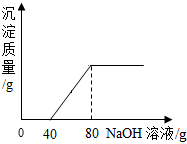 在一烧杯中盛有100g CuSO4和H2SO4的混合溶液向其中逐渐滴加溶质质量分数为10%的NaOH溶液,混合溶液的质量与所滴入NaOH溶液的质量关系曲线如图所示.请根据题意回答下列问题:
在一烧杯中盛有100g CuSO4和H2SO4的混合溶液向其中逐渐滴加溶质质量分数为10%的NaOH溶液,混合溶液的质量与所滴入NaOH溶液的质量关系曲线如图所示.请根据题意回答下列问题:
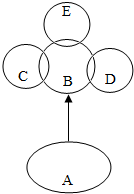 A、B、C、D、E分别是初中常见的五种物质,如图所示,“→”表示A可以在一定条件下生成B和一种无色无味的常见液体,且A通常情况下也为无色液体;C、D、E都能与B发生反应,且C与B反应的产物能使澄清的石灰水变浑浊,D能被磁铁所吸引,E为淡黄色粉末,回答问题:
A、B、C、D、E分别是初中常见的五种物质,如图所示,“→”表示A可以在一定条件下生成B和一种无色无味的常见液体,且A通常情况下也为无色液体;C、D、E都能与B发生反应,且C与B反应的产物能使澄清的石灰水变浑浊,D能被磁铁所吸引,E为淡黄色粉末,回答问题: 称取NaCl和BaCl2的固体混合物32.5g,加入200g蒸馏水,完全溶解后向该
称取NaCl和BaCl2的固体混合物32.5g,加入200g蒸馏水,完全溶解后向该