题目内容
13.向26.4g氯化钠和碳酸钠的混合物中滴加盐酸溶液,直到不再产生气体为止(假设气体全部溢出),共用去73g质量分数为10%的盐酸溶液.求:(1)原混合物中碳酸钠的质量.
(2)反应后溶液中溶质的质量分数(结果保留到0.1%).
分析 根据稀盐酸的质量计算出Na2CO3的质量,进而求出混合物中NaCl的质量;第二小问反应后溶液中的溶质NaCl的包括混合物中自有的和反应生成的两部分,反应后溶液的总质量等于加进去的固体混合物的质量加上加进去的稀盐酸的质量减去生成的气体的质量,最后用反应后溶液中溶质的质量除以反应后溶液的质量即可;据此解答.
解答 解:(1)盐酸溶液中溶质的质量为:73g×10%=7.3g;
设碳酸钠的质量为x、生成的氯化钠的质量为y,生成的二氧化碳的质量为z.
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 117 44
x 7.3g y z
则$\frac{106}{x}=\frac{73}{7.3g}=\frac{117}{y}=\frac{44}{z}$,解得x=10.6g;y=11.7g;z=4.4g
原混合物中NaCl的质量为26.4g-10.6g=15.8g
(2)反应后溶液中NaCl的总质量为15.8g+11.7g=27.5g
反应后溶液的质量分数为=$\frac{27.5g}{26.4g+73g-4.4g}×100%$≈28.9%
故答案为:
(1)10.6g;(2)28.9%.
点评 计算反应后溶液的溶质质量分数时,要注意原混合物中的氯化钠因溶解也是反应后溶液中溶质的一部分.根据质量守恒定律,反应质量所得溶液质量=固体混合物的质量+所加入稀盐酸的质量-反应放出二氧化碳的质量.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案
相关题目
1.海水是巨大的资源宝库,利用海水为原料获得许多化工产品的流程如图:
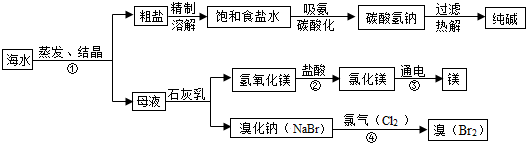
(1)实验室去除粗盐中难溶性杂质的一般步骤是:溶解、过滤、蒸发、计算产率;
(2)步骤①中选用蒸发结晶而不用降温结晶的理由是因为氯化钠的溶解度受温度影响小.
(3)由上述流程图看出碳酸氢钠的热稳定性小于(填“大于、小于或等于)纯碱的热稳定性.
(4)步骤②发生的反应属于复分解反应(填一种基本反应类型).用镁制造的一种镁铝合金常用作生产飞机外壳的材料,该材料具有的优良性能有质轻、强度大(任答一点).
(5)步骤④发生的反应为置换反应(类似于金属与盐溶液之间的反应),反应后溴元素的化合价比反应前升高(填“升高”或“降低”或“不变”).
(6)通过海水为原料制取纯碱中会含有杂质氯化钠,为了测定纯碱中杂质氯化钠的质量分数,小阳同学进行了三次实验,实验数据如下表:
完成下列计算:
①固体样品中氯化钠的质量分数是15.2%;
②第 2 次反应结束后溶液中溶质质量分数是多少?(写出必要的计算题过程)

(1)实验室去除粗盐中难溶性杂质的一般步骤是:溶解、过滤、蒸发、计算产率;
(2)步骤①中选用蒸发结晶而不用降温结晶的理由是因为氯化钠的溶解度受温度影响小.
(3)由上述流程图看出碳酸氢钠的热稳定性小于(填“大于、小于或等于)纯碱的热稳定性.
(4)步骤②发生的反应属于复分解反应(填一种基本反应类型).用镁制造的一种镁铝合金常用作生产飞机外壳的材料,该材料具有的优良性能有质轻、强度大(任答一点).
(5)步骤④发生的反应为置换反应(类似于金属与盐溶液之间的反应),反应后溴元素的化合价比反应前升高(填“升高”或“降低”或“不变”).
(6)通过海水为原料制取纯碱中会含有杂质氯化钠,为了测定纯碱中杂质氯化钠的质量分数,小阳同学进行了三次实验,实验数据如下表:
| 编 号 | 第 1 次 | 第 2次 | 第 3次 |
| 所取固体样品的质量/g | 13 | 10 | 10 |
| 样品用98g水溶解后,加入CaCl2溶液的质量/g | 100 | 100 | 125 |
| 反应后生成沉淀的质量/g | 8 | 8 | 8 |
①固体样品中氯化钠的质量分数是15.2%;
②第 2 次反应结束后溶液中溶质质量分数是多少?(写出必要的计算题过程)
18.下列反应的化学方程式及基本反应类型都正确的是( )
| A. | 用过氧化氢溶液和二氧化锰制氧气 2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑ 分解反应 | |
| B. | 用生石灰制熟石灰 CaO+H2O═Ca(OH)2 化合反应 | |
| C. | 用澄清石灰水鉴定CO2气体 CO2+Ca(OH)2═CaCO3↓+H2O 复分解反应 | |
| D. | 工业上用赤铁矿炼铁 3CO+Fe2O3$\frac{\underline{\;点燃\;}}{\;}$ 2Fe+3CO2 置换反应 |
5.某学校化学兴趣小组的同学对我市南部山区的大理石矿区进行调查并取样.样品的主要成分是碳酸钙(其中含有二氧化硅等杂质).下面是同学们的实验探究过程,请你参与并回答有关.
【实验目的】测定大理石样品中碳酸钙的质量分数.
【查阅资料】二氧化硅等杂质不溶于水,也不与盐酸反应.
【实验过程】准确称量5.0g大理石样品于烧杯中,向其中加入40mL质量分数为20%的盐酸,立即将烧杯放在电子秤上称量.每分钟记录一次数据(提示:反应结束后盐酸有剩余).
相关的实验数据如下表:
【数据处理】
(1)表中有一个称量数据是不合理的,该数据的测定时间是5分钟.
(2)计算样品中碳酸钙的质量分数.(写出计算过程,计算结果保留一位小数)
【反思交流】实验结束后,部分同学认为测得的碳酸钙质量分数偏大,请你分析出现此情况的原因可能是烧杯减少的质量除二氧化碳外还含有盐酸挥发出的氯化氢气体.
【实验目的】测定大理石样品中碳酸钙的质量分数.
【查阅资料】二氧化硅等杂质不溶于水,也不与盐酸反应.
【实验过程】准确称量5.0g大理石样品于烧杯中,向其中加入40mL质量分数为20%的盐酸,立即将烧杯放在电子秤上称量.每分钟记录一次数据(提示:反应结束后盐酸有剩余).
相关的实验数据如下表:
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 质量/g | 102.0 | 101.0 | 100.5 | 100.2 | 100.1 | 100.4 | 100.1 | 100.1 | 100.1 |
(1)表中有一个称量数据是不合理的,该数据的测定时间是5分钟.
(2)计算样品中碳酸钙的质量分数.(写出计算过程,计算结果保留一位小数)
【反思交流】实验结束后,部分同学认为测得的碳酸钙质量分数偏大,请你分析出现此情况的原因可能是烧杯减少的质量除二氧化碳外还含有盐酸挥发出的氯化氢气体.
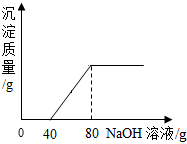 在一烧杯中盛有100g CuSO4和H2SO4的混合溶液向其中逐渐滴加溶质质量分数为10%的NaOH溶液,混合溶液的质量与所滴入NaOH溶液的质量关系曲线如图所示.请根据题意回答下列问题:
在一烧杯中盛有100g CuSO4和H2SO4的混合溶液向其中逐渐滴加溶质质量分数为10%的NaOH溶液,混合溶液的质量与所滴入NaOH溶液的质量关系曲线如图所示.请根据题意回答下列问题: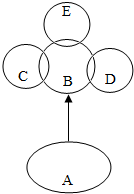 A、B、C、D、E分别是初中常见的五种物质,如图所示,“→”表示A可以在一定条件下生成B和一种无色无味的常见液体,且A通常情况下也为无色液体;C、D、E都能与B发生反应,且C与B反应的产物能使澄清的石灰水变浑浊,D能被磁铁所吸引,E为淡黄色粉末,回答问题:
A、B、C、D、E分别是初中常见的五种物质,如图所示,“→”表示A可以在一定条件下生成B和一种无色无味的常见液体,且A通常情况下也为无色液体;C、D、E都能与B发生反应,且C与B反应的产物能使澄清的石灰水变浑浊,D能被磁铁所吸引,E为淡黄色粉末,回答问题: