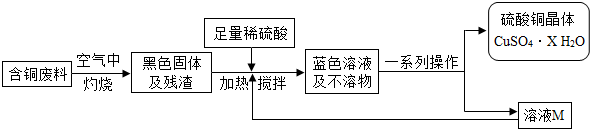
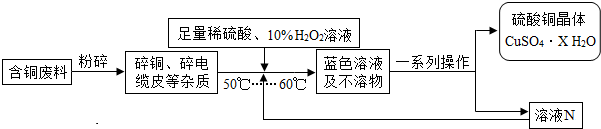
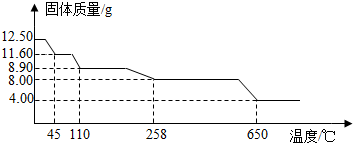
题目内容
为了测定碳酸钠样品(内含有氯化钠)的纯度,现将10克样品加入重为5克的烧杯中,再往烧杯中加入40克水搅拌至固体完全溶解,再向烧杯中加入50克稀盐酸,恰好不再产生气泡,称得烧杯总质量为102.8克.
请完成下列计算:
(1)反应产生的气体的质量是多少?
(2)碳酸钠样品中碳酸钠的质量分数是多少?
(3)盐酸溶液中溶质的质量分数是多少?
请完成下列计算:
(1)反应产生的气体的质量是多少?
(2)碳酸钠样品中碳酸钠的质量分数是多少?
(3)盐酸溶液中溶质的质量分数是多少?
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:(1)反应前后烧杯内物质的总质量之差为二氧化碳的质量;
(2)根据碳酸钠与盐酸反应的化学方程式利用二氧化碳的质量求出碳酸钠的质量,再求质量分数;
(3)根据碳酸钠与盐酸反应的化学方程式利用二氧化碳的质量求出盐酸溶液中溶质的质量,再根据盐酸的质量求质量分数.
(2)根据碳酸钠与盐酸反应的化学方程式利用二氧化碳的质量求出碳酸钠的质量,再求质量分数;
(3)根据碳酸钠与盐酸反应的化学方程式利用二氧化碳的质量求出盐酸溶液中溶质的质量,再根据盐酸的质量求质量分数.
解答:解:(1)根据质量守恒定律,产生气体的质量为:10g+5g+40g+50g-102.8g=2.2g;
解:设碳酸钠样品中碳酸钠的质量为X,盐酸溶液中溶质的质量分数为y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 44
X 50g×y 2.2g
106:44=X:2.2g 73:44=(50g×y):2.2g
解得:X=5.3g y=7.3%
(2)样品中碳酸钠的质量分数为:
×100%=53%
(3)盐酸溶液中溶质的质量分数为7.3%
答:反应产生的气体的质量是2.2g;碳酸钠样品中碳酸钠的质量分数是53%;盐酸溶液中溶质的质量分数为7.3%.
解:设碳酸钠样品中碳酸钠的质量为X,盐酸溶液中溶质的质量分数为y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 44
X 50g×y 2.2g
106:44=X:2.2g 73:44=(50g×y):2.2g
解得:X=5.3g y=7.3%
(2)样品中碳酸钠的质量分数为:
| 5.3g |
| 10g |
(3)盐酸溶液中溶质的质量分数为7.3%
答:反应产生的气体的质量是2.2g;碳酸钠样品中碳酸钠的质量分数是53%;盐酸溶液中溶质的质量分数为7.3%.
点评:利用反应前后物质的质量之差即为反应生成的气体的质量来解决问题.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目


 化石燃料在燃烧过程中会产生各种废气,确实给我们的环境带来了比较严重的影响.请观察如图,并根据要求回答下列问题:
化石燃料在燃烧过程中会产生各种废气,确实给我们的环境带来了比较严重的影响.请观察如图,并根据要求回答下列问题: