题目内容
13.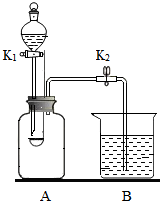 用如图所示装置进行实验.A的容积为350mL,装置气密性良好,实验前K1、K2均已关闭.
用如图所示装置进行实验.A的容积为350mL,装置气密性良好,实验前K1、K2均已关闭.(1)测定空气中氧气的含量A中预先放入30mL的水,B中盛有水.用凸透镜引燃燃烧匙中的白磷,反应的化学方程式为4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5.待冷却后打开K2,观察到B中的水减少了64mL,则A中O2的体积分数计算式为$\frac{64mL}{350mL-30mL}×$100%.
(2)研究二氧化碳的性质
A中盛有二氧化碳,分液漏斗中盛放氢氧化钠浓溶液,B中盛放稀盐酸.证明二氧化碳与氢氧化钠发生了反应的实验操作是:打开K1,待液体流下,关闭K1;一段时间后,打开K2.实验过程中观察到的现象是B中液体倒吸入A中,A中有气泡冒出,产生以上现象的原因是CO2与NaOH反应生成Na2CO3,使A中气体减少,压强减小,B中液体倒吸入A中;稀盐酸与Na2CO3反应生成CO2气体,有气泡冒出.
分析 (1)根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写;根据集气瓶内气体体积的变化来分析;
(2)根据CO2与NaOH反应生成Na2CO3,使A中气体减少,压强减小温解答.
解答 解:(1)白磷在空气中燃烧生成五氧化二磷,反应的化学方程式为4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5;待冷却后打开K2,观察到B中的水减少了64mL,即为消耗的氧气的体积,
则A中O2的体积分数计算式为$\frac{64mL}{350mL-30mL}×$100%;
(2)A中盛有二氧化碳,分液漏斗中盛放氢氧化钠浓溶液,B中盛放稀盐酸.证明二氧化碳与氢氧化钠发生了反应的实验操作是:打开K1,待液体流下,关闭K1;一段时间后,打开K2.实验过程中观察到的现象是B中液体倒吸入A中,A中有气泡冒出;产生以上现象的原因是CO2与NaOH反应生成Na2CO3,使A中气体减少,压强减小,B中液体倒吸入A中;稀盐酸与Na2CO3反应生成CO2气体,有气泡冒出.
答案:
(1)4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5; $\frac{64mL}{350mL-30mL}×$100%;
(2)B中液体倒吸入A中,A中有气泡冒出;CO2与NaOH反应生成Na2CO3,使A中气体减少,压强减小,B中液体倒吸入A中;稀盐酸与Na2CO3反应生成CO2气体,有气泡冒出.
点评 题考查了氧气含量的测定、化学方程式的书写以及气体体积分数的计算,掌握化学基本知识是解题的关键.

练习册系列答案
相关题目
3.下列变化中,属于化学变化的是( )
| A. | 香水挥发 | B. | 煤的炼焦 | C. | 车胎爆炸 | D. | 干冰升华 |
4.一些食物的近似PH如表:
人的胃液中含有盐酸,对于胃酸过多的人,空腹时最宜食用上述食物中的( )
| 食 物 | 苹 果 | 葡 萄 | 牛 奶 | 玉米粥 |
| pH | 2.9-3.3 | 3.5-4.5 | 6.3-6.6 | 6.8-8.0 |
| A. | 苹果 | B. | 葡萄 | C. | 牛奶 | D. | 玉米粥 |
8.如表是几种家用清洁剂.
根据表中信息,回答下列问题.
(1)在盛有少量“彩漂液”的试管中,加少量二氧化锰,发生反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(2)“管道通”可使堵塞的管道畅通无阻,在使用时禁止与皮肤接触,其原因是NaOH具有强烈的腐蚀性,也不能与“洁厕灵”混合使用,其原因是NaOH+HCl═NaCl+H2O(用化学方程式表示).
| 清洁剂 |  彩漂液 |  洁厕灵 |  管道通 |
| 功 能 | 漂洗衣物,使色彩鲜艳 | 清除污垢,除异味 | 官道疏通,防堵塞 |
| 有效成分 | 过氧化氢 | 盐酸(HCl) | 氢氧化钠 |
(1)在盛有少量“彩漂液”的试管中,加少量二氧化锰,发生反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(2)“管道通”可使堵塞的管道畅通无阻,在使用时禁止与皮肤接触,其原因是NaOH具有强烈的腐蚀性,也不能与“洁厕灵”混合使用,其原因是NaOH+HCl═NaCl+H2O(用化学方程式表示).
5.某校研究性学习活动小组利用课余时间调查雾霾产生的原因,并提出可减少的雾霾说法正确的是( )
| A. | 鼓励开私家车出行 | B. | 鼓励使用太阳能热水器 | ||
| C. | 鼓励用煤火力发电 | D. | 鼓励露天焚烧垃圾 |



 某化学兴趣小组为测定一种石灰石样品中碳酸钙的质量分数,进行如下实验:
某化学兴趣小组为测定一种石灰石样品中碳酸钙的质量分数,进行如下实验: