题目内容
1.煤制气-竖炉直接还原铁矿石工艺流程如图所示.
回答下列问题.
(1)合成气属于混合物(填“纯净物”或“混合物”).
(2)用化学方程式表示还原反应室内炼铁的原理Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2(写一个).
(3)该工艺流程中,可循环利用的物质是二氧化碳和水.
分析 (1)根据合成气是一氧化碳和氢气中的混合气进行分析;
(2)根据炼铁的反应原理来完成解答;
(3)根据甲烷燃烧的产物和该流程最后所产生的气体来完成解答即可.
解答 解:(1)合成气是一氧化碳和氢气中的混合气,属于混合物;
(2)从图中可以得出一氧化碳和氢气进入竖炉中充当了还原剂,所以发生的反应为氢气和氧化铁以及一氧化碳和氧化铁的反应,反应的化学方程式分别为:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2、3H2+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3H2O;
(3)甲烷燃烧的产物为二氧化碳和水,而高温尾气的成分也为二氧化碳和水,它们进入催化反应室中可以得到合成气体(一氧化碳和氢气),所以可以判断在该过程中能够被循环利用的物质为二氧化碳和水.
故答案为:(1)混合物;
(2)Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(3)H2O.
点评 本题考查的是炼铁的知识,完成此题,可以依据已有的物质的性质进行.

练习册系列答案
相关题目
9.烧杯中装有一定量的盐酸和硫酸铜的混合溶液,已知该溶液中含有HCl的质量为3.65g.某同学为测定该混合溶液中硫酸铜的质量,向烧杯中逐渐加入10%的NaOH溶液,得到沉淀的质量如下表所示:
请回答下列问题:
(1)最终得到沉淀的总质量为4.90g
(2)参加反应的NaOH溶液的总质量是多少克?(结果保留小数点后面一位)
| 加入NaOH溶液的质量/g | 20.0 | 40.0 | 60.0 | 80.0 | 100.0 |
| 生成沉淀的质量/g | 0.0 | 0.00 | 2.45 | 4.90 | 4.90 |
(1)最终得到沉淀的总质量为4.90g
(2)参加反应的NaOH溶液的总质量是多少克?(结果保留小数点后面一位)
11.下列当涂特产与化学变化无关的是( )
| A. | 黄池茶干 | B. | 博望横望山米酒 | C. | 太白长江钢铁 | D. | 姑孰布贴画 |
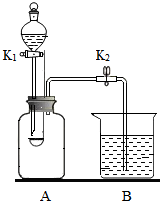 用如图所示装置进行实验.A的容积为350mL,装置气密性良好,实验前K1、K2均已关闭.
用如图所示装置进行实验.A的容积为350mL,装置气密性良好,实验前K1、K2均已关闭.