题目内容
18.在等质量、等质量分数的两份稀硫酸中,分别投入等质量的铁和锌,反应结束后,发现剩余的铁比锌多,则两份溶液中产生的氢气( )| A. | 放铁的比放锌的多 | B. | 放铁的比放锌的少 | ||
| C. | 一样多 | D. | 无法确定 |
分析 据质量守恒定律可知:生成氢气的质量等于酸中氢元素的质量,所以足量的两种二价金属与硫酸反应,得到氢气的质量相等.
解答 解:等质量、等质量分数的两份稀硫酸分别与足量的铁和锌反应,发现剩余的铁比锌多,说明硫酸完全反应,据质量守恒定律可知:生成氢气的质量等于参加反应的酸中氢元素的质量,故生成氢气的质量相等;
故选:C.
点评 等质量、等质量分数的两份稀硫酸分别与足量的金属反应,生成氢气的质量相等.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
8.下列过程中不发生化学变化的是( )
| A. |  用稀盐酸在鸡蛋壳上作画 | B. |  用炉具清洁剂去油污 | ||
| C. |  用生石灰作食品干燥剂 | D. |  用洗涤剂去餐具上的油污 |
19.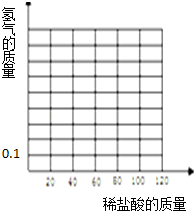 某同学为了测试一段表面被氧化的镁条的纯度.取11.6g该镁条于烧杯中,向烧杯中分五次加入等质量的同种稀盐酸,实验过程中得到的数据如下:
某同学为了测试一段表面被氧化的镁条的纯度.取11.6g该镁条于烧杯中,向烧杯中分五次加入等质量的同种稀盐酸,实验过程中得到的数据如下:
(注:MgO+2HCl═MgCl2+H2O)
(1)m 的值为0.2;
(2)根据上述数据计算出镁条的纯度;(要求写出计算过程,结果精确到0.1%,下同)
(3)反应结束后所得溶液中氯化镁的质量分数为38.6%;
(4)在坐标图中画出所加盐酸与产生氢气的质量关系图.
 某同学为了测试一段表面被氧化的镁条的纯度.取11.6g该镁条于烧杯中,向烧杯中分五次加入等质量的同种稀盐酸,实验过程中得到的数据如下:
某同学为了测试一段表面被氧化的镁条的纯度.取11.6g该镁条于烧杯中,向烧杯中分五次加入等质量的同种稀盐酸,实验过程中得到的数据如下:| 第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
| 加入稀盐酸的质量 | 20g | 20g | 20g | 20g | 20g |
| 产生氢气的质量 | 0.1g | 0.2g | 0.2g | mg | 0.1g |
(1)m 的值为0.2;
(2)根据上述数据计算出镁条的纯度;(要求写出计算过程,结果精确到0.1%,下同)
(3)反应结束后所得溶液中氯化镁的质量分数为38.6%;
(4)在坐标图中画出所加盐酸与产生氢气的质量关系图.
 如图所示,是某同学设计的用高锰酸钾制取并收集氧气的装置图,根据图形回答有关问题:
如图所示,是某同学设计的用高锰酸钾制取并收集氧气的装置图,根据图形回答有关问题: A是某工厂废旧车床表面上红色固体的主要成分,B、C、E都是单质,D、E都没有颜色和气味,A~F是初中化学常见物质.它们之间的相互转化关系如图:
A是某工厂废旧车床表面上红色固体的主要成分,B、C、E都是单质,D、E都没有颜色和气味,A~F是初中化学常见物质.它们之间的相互转化关系如图:
 现有A~G七种物质,已知A是赤铁矿的主要成分,B是可燃性气体单质,G溶液为蓝色,它们之间存在如图所示的转化关系:
现有A~G七种物质,已知A是赤铁矿的主要成分,B是可燃性气体单质,G溶液为蓝色,它们之间存在如图所示的转化关系: ,碳原子的核电荷数为6.
,碳原子的核电荷数为6.