题目内容
15.小亮在做“盐酸中和氢氧化钠溶液”实验时,滴加盐酸前忘了加入指示剂,导致无法判断该中和反应进行的程度.于是他对所得溶液的酸碱性进行探究.请你和他一起探究:提出猜想:所得溶液可能呈碱性.
设计实验验证你的猜想:
| 实验操作 | 实验现象 | 结论 |
| 取少量混合液于试管中,再滴入几滴紫色石蕊溶液 | 溶液变蓝色 | 所得溶液呈碱性 |
分析 提出猜想根据盐酸与氢氧化钠的量分析反应后溶液的酸碱性;根据紫色石蕊溶液在溶液中的变色情况分析溶液的酸碱性;
解答 解:盐酸与氢氧化钠混合,会发生反应,由于加入的酸的量不固定故溶液可能呈碱性、中性或酸性;
提出猜想:所得溶液可能呈碱性;
设计实验:取少量混合液于试管中,再滴入几滴紫色石蕊溶液,溶液变蓝色,所得溶液呈碱性.
答案:碱;
| 实验操作 | 实验现象 | 结论 |
| 取少量混合液于试管中,再滴入几滴紫色石蕊溶液 | 溶液变蓝色 | 所得溶液呈碱性 |
点评 本题主要对酸碱反应后所得溶液的酸碱性进行探究.解题时主要利用了酸碱的性质进行分析解答.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
5.某不纯的氯化钠样品中只含有一种杂质,取该样品11.7克,溶于适量水中,然后加入足量的硝酸银溶液,得到29.7克白色沉淀,则所含杂质不可能是( )
| A. | 氯化镁 | B. | 氯化钙 | C. | 氯化铝 | D. | 氯化钾 |
6.某校“酸雨”测量小组的同学,取刚降落雨水的水样,用pH探头(测pH的仪器)每隔几分钟测一次pH,其数据如下:
(1)”正常雨水”(不是酸雨)的pH<7,根据所学的有关知识,用化学方程式解释引起这种pH的原因H2O+CO2=H2CO3;
(2)根据以上数据,判断所降雨水是否为“酸雨”(填是或否)是,在测定期间,此雨水pH的变化趋势是变小.
(3)经调查,这一地区有一个硫酸厂和一个电镀厂,这些厂使用的燃料主要是煤,燃烧时产生二氧化硫等气体,为了避免酸雨的产生,可以用氢氧化钠溶液吸收二氧化硫,其反应的化学方程式为:2NaOH+SO2=Na2SO3+H2O.
(4)实验室稀释浓硫酸的正确操作是把浓硫酸沿着器壁慢慢地注入水中,并不断搅动,使产生的热迅速地扩散.
| 测定时刻 | 5:05 | 5:10 | 5:15 | 5:20 | 5:25 | 5:30 | 5:35 |
| PH | 4.95 | 4.94 | 4.94 | 4.88 | 4.86 | 4.85 | 4.85 |
(2)根据以上数据,判断所降雨水是否为“酸雨”(填是或否)是,在测定期间,此雨水pH的变化趋势是变小.
(3)经调查,这一地区有一个硫酸厂和一个电镀厂,这些厂使用的燃料主要是煤,燃烧时产生二氧化硫等气体,为了避免酸雨的产生,可以用氢氧化钠溶液吸收二氧化硫,其反应的化学方程式为:2NaOH+SO2=Na2SO3+H2O.
(4)实验室稀释浓硫酸的正确操作是把浓硫酸沿着器壁慢慢地注入水中,并不断搅动,使产生的热迅速地扩散.
3. 如图是某粒子的结构示意图,与图中的“1”直接相关的是( )
如图是某粒子的结构示意图,与图中的“1”直接相关的是( )
 如图是某粒子的结构示意图,与图中的“1”直接相关的是( )
如图是某粒子的结构示意图,与图中的“1”直接相关的是( )| A. | 元素的化学性质 | B. | 质子数 | C. | 电子总数 | D. | 电子层数 |
20.下列说法正确的是( )
| A. | 用pH试纸测得某雨水的PH为4.1,则可判定该雨水一定为酸雨 | |
| B. | 锌和浓硫酸反应可生成氢气和硫酸锌 | |
| C. | 有盐和水生产的反应不一定是中和反应 | |
| D. | 向某溶液中滴入无色酚酞,溶液变红色,则该溶液一定为碱溶液 |
7.20℃时,氯化钠的溶解度为36g.对这句话理解正确的是( )
| A. | 100g水中最多能溶解氯化钠36g | |
| B. | 20℃时,100g氯化钠饱和溶液中含氯化钠36g | |
| C. | 20℃时,氯化钠饱和溶液中溶质的质量分数为36% | |
| D. | 20℃时,136g氯化钠饱和溶液中含有36g氯化钠 |
4.下列实验操作中,符合操作规范的是( )
| A. | 把氢氧化钠固体直接放在天平左盘上称量 | |
| B. | 点燃可燃性气体前一定先检验气体的纯度 | |
| C. | 测定某溶液的pH时,先用水润湿pH试纸,再将待测液滴到pH试纸上 | |
| D. | 把浓硫酸沿器壁缓慢注入盛有水的量筒内稀释 |
9.在pH=7的溶液中滴入紫色石蕊试液,溶液将显( )
| A. | 红色 | B. | 无色 | C. | 紫色 | D. | 无色 |
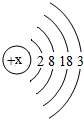 1875年,法国化学家布瓦博德朗公布了他发现的新元素镓(元素符号为Ga)的性质:镓是银白色金属,能与沸水剧烈反应生成氢气和氢氧化镓.目前金属镓广泛用于制造半导体材料.镓的原子结构示意图如图.
1875年,法国化学家布瓦博德朗公布了他发现的新元素镓(元素符号为Ga)的性质:镓是银白色金属,能与沸水剧烈反应生成氢气和氢氧化镓.目前金属镓广泛用于制造半导体材料.镓的原子结构示意图如图.