题目内容
下表是固体A和固体B在不同温度时的溶解度.
(1)从表中数据可以看出固体A和固体B的溶解度随温度升高而 (填“增大”或“减小”).
(2)20℃时,把50g固体A放入100g水中,充分溶解后,所得溶液质量为 g.
(3)40℃时,A、B两种物质的饱和溶液中溶质的质量分数较大的是 .
(4)若B饱和溶液中有少量的A,可用下列 法提纯B(填序号).
①趁热过滤 ②蒸发结晶 ③冷却热饱和溶液.
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | |
| 溶解度/g | 固体A | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
| 固体B | 13.3 | 31.6 | 63.9 | 110 | 169 | |
(2)20℃时,把50g固体A放入100g水中,充分溶解后,所得溶液质量为
(3)40℃时,A、B两种物质的饱和溶液中溶质的质量分数较大的是
(4)若B饱和溶液中有少量的A,可用下列
①趁热过滤 ②蒸发结晶 ③冷却热饱和溶液.
考点:固体溶解度的影响因素,结晶的原理、方法及其应用,溶质的质量分数、溶解性和溶解度的关系
专题:溶液、浊液与溶解度
分析:(1)从表中数据可以看出固体A的溶解度由35.7g~38.4g,固体B的溶解度由13.3g~169g,去分析解答;
(2)从在20℃时,固体A的溶解度为36.0g,其含义为:在20℃时,100水是最多可溶解固体A的质量为36.0;20℃时,把50g固体A放入100g水中,固体A有剩余去分析解答;
(3)从由一定温度下,饱和溶液里:溶质量质量分数=
×100%=
×100%可知.溶解度越大,质量分数越大去分析解答;
(4)从由于A、B两种物质的溶解度受温度的影响不同,可用冷却的热饱和溶液方法提纯B去分析解答.
(2)从在20℃时,固体A的溶解度为36.0g,其含义为:在20℃时,100水是最多可溶解固体A的质量为36.0;20℃时,把50g固体A放入100g水中,固体A有剩余去分析解答;
(3)从由一定温度下,饱和溶液里:溶质量质量分数=
| 溶解度 |
| 100g+溶解度 |
| 1 | ||
|
(4)从由于A、B两种物质的溶解度受温度的影响不同,可用冷却的热饱和溶液方法提纯B去分析解答.
解答:解:(1)从表中数据可以看出固体A的溶解度由35.7g~38.4g,固体B的溶解度由13.3g~169g,二者的溶解度都随温度升高而增大;故答案为:增大;
(2)由表中可以看出在20℃时,固体A的溶解度为36.0g,其含义为:在20℃时,100水是最多可溶解固体A的质量为36.0;20℃时,把50g固体A放入100g水中,固体A有剩余,剩余的质量为:50g-36.0g=14.0g,所以溶液的质量为:100g+36.0g=136.0g;故答案为:136.0;
(3)由一定温度下,饱和溶液里:溶质量质量分数=
×100%=
×100%可知.溶解度越大,质量分数越大;由于40℃时,A的溶解度为36.6g小于B物质的溶解度:63.9g,所以此时溶质质量分数较大的是B;故答案为:B;
(4)由于A、B两种物质的溶解度受温度的影响不同,冷却B的热饱和溶液,有B晶体析出,少量的A留在滤液中,可达到提纯B的目的;故答案为:③.
(2)由表中可以看出在20℃时,固体A的溶解度为36.0g,其含义为:在20℃时,100水是最多可溶解固体A的质量为36.0;20℃时,把50g固体A放入100g水中,固体A有剩余,剩余的质量为:50g-36.0g=14.0g,所以溶液的质量为:100g+36.0g=136.0g;故答案为:136.0;
(3)由一定温度下,饱和溶液里:溶质量质量分数=
| 溶解度 |
| 100g+溶解度 |
| 1 | ||
|
(4)由于A、B两种物质的溶解度受温度的影响不同,冷却B的热饱和溶液,有B晶体析出,少量的A留在滤液中,可达到提纯B的目的;故答案为:③.
点评:计算溶液的质量时,没有溶解的溶质的质量不能计算在内.

练习册系列答案
相关题目
下列四组溶液,仅用组内物质就能鉴别出来的是( )
| A、K2CO3 FeCl3 KOH H2SO4 |
| B、NaCl MgCl2 K2SO4 CuSO4 |
| C、NH4HCO3 Ba(OH)2 H2SO4 NaNO3 |
| D、K2CO3 Na2SO4 BaCl2 NaOH |
下列清洗过程中,发生了乳化现象的是( )
| A、用汽油清除油污 |
| B、用盐酸清除铁锈 |
| C、用乙醇清除碘酒 |
| D、用洗涤剂清除油污 |
 生产、生活中常需配制溶液.
生产、生活中常需配制溶液.
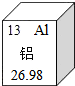 铝元素与人类关系密切.
铝元素与人类关系密切. 点燃不纯的可燃性气体可能发生爆炸,如图是某同学的改进装置.请回答.
点燃不纯的可燃性气体可能发生爆炸,如图是某同学的改进装置.请回答. 2014年我国纪念“世界水日”和“中国水周”活动的宣传主题为“加强河湖管理,建设水生态文明”,我们应该珍惜和爱护水资源
2014年我国纪念“世界水日”和“中国水周”活动的宣传主题为“加强河湖管理,建设水生态文明”,我们应该珍惜和爱护水资源