题目内容
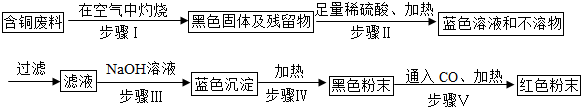
15.一包白色固体混合物,可能由氯化钠、碳酸钾、硫酸钠、氯化钡中的一种或几种混合而成,为确定其组成进行如图所示的实验:
试推断:(1)白色沉淀A是碳酸钡.
(2)混合物中一定含有的物质是碳酸钾、氯化钡.
分析 根据硫酸钠和氯化钡生成不溶于酸的硫酸钡沉淀,碳酸钾和氯化钡会生成溶于酸的碳酸钡沉淀,并生成二氧化碳气体,氯离子和硝酸银会生成白色的氯化银沉淀等知识进行分析.
解答 解:硫酸钠和氯化钡生成不溶于酸的硫酸钡沉淀,碳酸钾和氯化钡会生成溶于酸的碳酸钡沉淀,并生成二氧化碳气体,氯离子和硝酸银会生成白色的氯化银沉淀.
白色固体混合物加水溶解,得到白色沉淀A和无色滤液,无色滤液和硝酸银会生成白色沉淀C,所以无色滤液中一定含有氯离子,白色沉淀A加盐酸,生成气体B,沉淀全部溶解,所以白色沉淀A是碳酸钡沉淀,一定不含硫酸钡沉淀,所以混合物中一定含有氯化钡、碳酸钾,一定不含硫酸钠,氯化钡和碳酸钾生成碳酸钡沉淀和氯化钾,无色滤液中含有氯离子,所以混合物中可能含有氯化钠,所以
(1)白色沉淀A是碳酸钡;
(2)混合物中一定含有的物质是:碳酸钾、氯化钡.
故答案为:(1)碳酸钡;
(2)碳酸钾、氯化钡.
点评 在解此类题时,首先分析题中所给物质的性质和两两之间的反应,然后依据题中的现象判断各物质的存在性,最后进行验证即可.

练习册系列答案
相关题目
3.为了探究某稀盐酸中溶质的质量分数,甲、乙两同学分别取溶质质量分数相等的稀盐酸100g,甲同学向其中加入氧化铜8g,反应结束后观察到固体全部消失;乙同学向其中加入氧化铜16g,反应结束后观察到固体有剩余.下列有关实验的推断正确的是( )
| A. | 反应后乙同学所得溶液中可能含盐酸 | |
| B. | 反应后向甲同学所得的溶液中滴加少量氢氧化钠溶液,一定会有蓝色沉淀生成 | |
| C. | 反应后甲、乙两同学所得的溶液中溶质的质量分数可能相等 | |
| D. | 原稀盐酸中溶质的质量分数一定大于7.3%小于14.6% |
10.小柯同学在学习了酶的知识后了解到了酶的催化作用要受到温度、酸碱度(pH)的影响.联系到前面学习的知识,小柯同学又提出了自己的一个猜想:酶的催化作用可能会受到重金属离子的影响.结合猜想小柯进行了如下探究:
【查阅资料】重金属指密度大于5克/厘米3的金属(一般指密度大于4.5克/厘米3的金属).
【设计实验】取试管4支,编号,按下表分别加入试剂,摇匀,迅速置于37℃的水浴中,10分钟后取出,冷却后分别加入碘液3滴,观察其颜色变化.
根据小柯同学的探究过程回答下列问题:
【实验结果】(1)若酶遇到重金属离子会失去活性.则第四组实验加入碘液3滴后的现象是变蓝色.
【交流和评价】(2)在看了小柯的设计及实验后,同桌的小温认为凭上述实验还不足以证明小柯的猜想.小温提出应该将实验中的CuSO4溶液更换成CuCl2溶液才更有说服力.小温的理由是排除硫酸根离子对实验的干扰或前面加氯化钠已经说明氯离子对实验无影响.
【拓展和应用】(3)若有人误食被电镀厂废水[含铬(Cr)、镍(Ni)、镉(Cd)]污染的食物而急性中毒,为解毒,下列四种供选物质中你不应该选择的是D.
A.鸡蛋清 B.鲜豆浆 C.鲜牛奶 D.糖水.
【查阅资料】重金属指密度大于5克/厘米3的金属(一般指密度大于4.5克/厘米3的金属).
【设计实验】取试管4支,编号,按下表分别加入试剂,摇匀,迅速置于37℃的水浴中,10分钟后取出,冷却后分别加入碘液3滴,观察其颜色变化.
| 编号 | 0.25%淀粉溶液(ml) | 蒸馏水(ml) | 1%NaCl 溶液(ml) | 1%CuSO4溶液(ml) | 唾液溶液(ml) | 加入碘液3滴后现象 |
| 1 | 3 | 2 | - | - | - | 变蓝色 |
| 2 | 3 | 1 | - | - | 1 | 不变蓝 |
| 3 | 3 | - | 1 | - | 1 | 不变蓝 |
| 4 | 3 | - | - | 1 | 1 | 变蓝色 |
【实验结果】(1)若酶遇到重金属离子会失去活性.则第四组实验加入碘液3滴后的现象是变蓝色.
【交流和评价】(2)在看了小柯的设计及实验后,同桌的小温认为凭上述实验还不足以证明小柯的猜想.小温提出应该将实验中的CuSO4溶液更换成CuCl2溶液才更有说服力.小温的理由是排除硫酸根离子对实验的干扰或前面加氯化钠已经说明氯离子对实验无影响.
【拓展和应用】(3)若有人误食被电镀厂废水[含铬(Cr)、镍(Ni)、镉(Cd)]污染的食物而急性中毒,为解毒,下列四种供选物质中你不应该选择的是D.
A.鸡蛋清 B.鲜豆浆 C.鲜牛奶 D.糖水.
20.下列根据现象所作出的推测,符合事实的是( )
| A. | 在某固体物质中加入稀盐酸,产生大量气泡$\stackrel{推测}{→}$该物质一定是碳酸盐 | |
| B. | 芝麻和黄豆混合前总体积大于混合后体积$\stackrel{推测}{→}$构成物质的分子之间存在着空隙 | |
| C. | 轻质带电小球A放在另一个轻质小球B旁受力偏转$\stackrel{推测}{→}$B球与A球带异种电荷 | |
| D. | 将干冷的烧杯罩在蜡烛的火焰上方,内壁出现小水珠$\stackrel{推测}{→}$蜡烛中含有氢元素 |
5.皮蛋于明朝初年问世.其腌制配方有多种,但主要配料为生石灰(CaO)、纯碱(Na2CO3)和食盐(NaCl).将一定比例的配料用水和粘土调制成糊状,敷于蛋上,密封保存,数日后可食用.
(1)腌制松花蛋配料用水调制时,主要发生化学反应的方程式有(不考虑粘土中物质可能参与的反应)CaO+H2O=Ca(OH)2,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
(2)皮蛋外的糊状物经溶解、过渡后,所得滤液中肯定大量含有的物质为NaCl、NaOH,可能含有的物质为Ca(OH)2或Na2CO3.
(3)某学生设计如下表示的实验方案,探究(2)所得滤液中可能含有的Ca(OH)2是否存在,请你帮助他完成实验方案.
(1)腌制松花蛋配料用水调制时,主要发生化学反应的方程式有(不考虑粘土中物质可能参与的反应)CaO+H2O=Ca(OH)2,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
(2)皮蛋外的糊状物经溶解、过渡后,所得滤液中肯定大量含有的物质为NaCl、NaOH,可能含有的物质为Ca(OH)2或Na2CO3.
(3)某学生设计如下表示的实验方案,探究(2)所得滤液中可能含有的Ca(OH)2是否存在,请你帮助他完成实验方案.
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量滤液滴加适量碳酸钾溶液 | 白色沉淀 | 滤液中含有Ca(OH)2 |
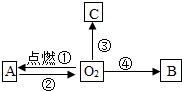 构建知识网络是一种重要的学习方法.如图是关于氧气化学性质的知识网络(“→”表示一种物质转化为另一种物质),其中B是能使澄清石灰水变浑浊的气体,C为黑色固体.请回答下列问题:
构建知识网络是一种重要的学习方法.如图是关于氧气化学性质的知识网络(“→”表示一种物质转化为另一种物质),其中B是能使澄清石灰水变浑浊的气体,C为黑色固体.请回答下列问题: