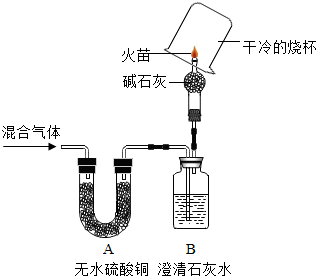
题目内容
12.下列物质的用途主要体现物质物理性质的是(( )| A. |  氧气用于气焊 | B. |  碳酸氢钠用作发酵粉 | ||
| C. |  干冰用于舞台效果 | D. |  熟石灰用于中和酸性土壤 |
分析 物质的化学性质是指在化学变化中表现出来的性质.化学性质主要有:可燃性、毒性、氧化性、还原性、稳定性等.
物质的物理性质是指不需要通过化学变化表现出来的性质.物理性质主要有:颜色、状态、气味、密度、硬度、熔点、沸点等.
解答 解:物理性质是不需要发生化学变化就表现出来的性质,包括颜色、状态、气味、味道、硬度、密度、熔点、沸点导电性、导热性、磁性、溶解性、挥发性等,特征是不通过化学变化就表现出来.
A、氧气用于气焊时是可燃气体和氧气反应生成了二氧化碳,这一性质是通过化学变化表现出来的,为化学性质,所以错误.
B、利用了碳酸氢钠能和显酸性的物质反应生成二氧化碳的性质,属于物质的化学性质.故选项错误;
C、干冰用于人工降雨是利用干冰升华吸热的性质,升华只是物质由固态直接变成了气态,该过程没有生成新物质,是物理变化,升华属于物理性质,所以正确.
D、熟石灰用于改良酸性土壤中利用中和反应原理,是通过化学变化才能表现出来的性质,为化学性质,所以错误.
故选C.
点评 解答本题要分析物质的性质是否需要通过化学变化表现出来,如果不需要通过化学变化表现出来就属于物质的物理性质.

练习册系列答案
相关题目
20.下列关于“生活中的化学”的叙述中,不正确的是( )
| A. | 胃酸过多可服用适量的小苏打 | |
| B. | 油锅着火可以立即用冷水浇灭 | |
| C. | 食用加碘食盐可预防甲状腺肿大 | |
| D. | 水中的色素和异味可以用活性炭除去 |
7.做一氧化碳还原氧化铜实验,一段时间后停止加热,测得剩余固体中铜元素与氧元素的质量之比为20:3,则已反应的氧化铜与原氧化铜的质量比是( )
| A. | 2:5 | B. | 3:5 | C. | 2:3 | D. | 1:5 |
17.分类、类比是学习化学常用的方法.
(1)金属资源储量有限,保扩金属资源是毎一个公民的义务.下面是一些常见的保护金属资源的事例:
①把某些金属制成合金 ②给自行车的链条涂油 ③用汽车用过的铅酸蓄电池再生铅
④铁制品表面镀上铬、镍等金属 ⑤用废电池的锌皮做制取氢气的实验
⑥将铝制品易拉罐置于“可回收”的垃圾桶内
请从保护金属资源有效途径的角度,将上述事例平均为两分类:
其中的一个分类标准是防止金属腐蚀;包括事例为①②④(填序号)
(2)在初中,我们已经学习过几种典型的酸,到了高中我们会学习到更多种类的酸:
观察表格,经过分析和类比回答:
①硫酸和高氯酸中,酸性相对更强的是高氯酸;
②高氯酸和氢氧化钡溶液反应,无明显现象.此反应的化学方程式为Ba(OH)2+2HClO4═Ba(ClO4)2+2H2O.
(1)金属资源储量有限,保扩金属资源是毎一个公民的义务.下面是一些常见的保护金属资源的事例:
①把某些金属制成合金 ②给自行车的链条涂油 ③用汽车用过的铅酸蓄电池再生铅
④铁制品表面镀上铬、镍等金属 ⑤用废电池的锌皮做制取氢气的实验
⑥将铝制品易拉罐置于“可回收”的垃圾桶内
请从保护金属资源有效途径的角度,将上述事例平均为两分类:
其中的一个分类标准是防止金属腐蚀;包括事例为①②④(填序号)
(2)在初中,我们已经学习过几种典型的酸,到了高中我们会学习到更多种类的酸:
| 非金属元素 | Si | P | S | Cl | |
| 最高价含氧酸 | 名称 | (偏)硅酸 | 磷酸 | 硫酸 | 高氯酸 |
| 化学式 | H2SiO3 | H3PO4 | H2SO4 | HClO4 | |
| 酸性 | 弱 | 中强 | 强 | 强 | |
①硫酸和高氯酸中,酸性相对更强的是高氯酸;
②高氯酸和氢氧化钡溶液反应,无明显现象.此反应的化学方程式为Ba(OH)2+2HClO4═Ba(ClO4)2+2H2O.
1.小明学习了氨碱法制纯碱后,对氨碱法制得的纯碱样品的成分很感兴趣.
【提出问题】该纯碱样品中含有哪些物质?
【猜想与假设】通过分析,小明做出如下假设:
(1)只含有Na2CO3;(2)含有Na2CO3和NaHCO3;(3)含有Na2CO3和NaCl;(4)含有Na2CO3、NaHCO3和NaCl.
【查阅资料】CaCl2溶液、Ca(NO3)2溶液呈中性;Ca(HCO3)2能溶于水,溶液呈碱性,受热易分解,能与酸反应.
【实验探究】为了测定纯碱样品的成分,小亮设计如下实验方案,请你一起完成小亮实验报告.
【实验反思】
实验步骤①中,硝酸钙溶液过量的目的是将样品溶液中的碳酸钠全部除去,避免干扰NaHCO3检验.
【提出问题】该纯碱样品中含有哪些物质?
【猜想与假设】通过分析,小明做出如下假设:
(1)只含有Na2CO3;(2)含有Na2CO3和NaHCO3;(3)含有Na2CO3和NaCl;(4)含有Na2CO3、NaHCO3和NaCl.
【查阅资料】CaCl2溶液、Ca(NO3)2溶液呈中性;Ca(HCO3)2能溶于水,溶液呈碱性,受热易分解,能与酸反应.
【实验探究】为了测定纯碱样品的成分,小亮设计如下实验方案,请你一起完成小亮实验报告.
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量样品溶于水,加入过量Ca(NO3)2的溶液 | 产生白色沉淀 | 该反应的化学方程式:Ca(NO3)2+Na2CO3═2NaNO3+CaCO3↓ |
| ②将上述反应后的混合液过滤,取滤液 加过量的稀硝酸 | 有气泡产生 | 该反应的方程式: NaHCO3+HNO3═NaNO3+H2O+CO2↑ |
| ③取②反应后的溶液,加入 硝酸银溶液 | 产生白色沉淀 | 证明猜想(4)成立 |
实验步骤①中,硝酸钙溶液过量的目的是将样品溶液中的碳酸钠全部除去,避免干扰NaHCO3检验.
2.生活中的下列做法不合理的是( )
| A. | 木材或纸张着火,用水灭火 | |
| B. | 天然气泄漏,立即打开排气扇通风换气 | |
| C. | 用纯碱代替洗涤剂洗碗 | |
| D. | 印刷厂的碱性废水,加入适量的硫酸中和 |
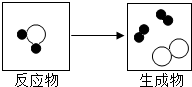 如图是某反应的微观粒子示意图.
如图是某反应的微观粒子示意图. B.两个
B.两个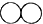 C.一个
C.一个 D.两个
D.两个