题目内容
4.某物质R完全燃烧的化学方程式为:2R+5O2$\frac{\underline{\;点燃\;}}{\;}$4CO2+2H2O.有关该反应,有下列说法:①R中一定含有碳、氢两种元素,可能含有氧元素
②R中碳元素和氢元素的质量比是12:1
③反应前后,各元素的化合价都没有改变
④R的相对分子质量等于26
则正确的一组是( )
| A. | ①② | B. | ①③ | C. | ②③ | D. | ②④ |
分析 根据质量守恒定律和化学方程式为2R+5O2$\frac{\underline{\;点燃\;}}{\;}$4CO2+2H2O,反应前后原子个数不变,可以确定R的化学式的组成,进而比较各元素的质量多少,以及R的相对分子质量;来分析解答;
解答 解:
根据质量守恒定律和化学方程式为2R+5O2$\frac{\underline{\;点燃\;}}{\;}$4CO2+2H2O,生成物中为共含有4个碳原子、10个氧原子、4个氢原子,根据质量守恒定律,化学反应前后各原子的种类和数目不变,反应前物质中只有10个氧原子,则R中含有2个碳原子、2个氢原子,其化学式为:C2H2.则:
①根据分析,R的化学式为:C2H2,则R中一定含有碳、氢两种元素,无氧元素;
②根据分析,R的化学式为:C2H2,R中碳元素和氢元素的质量比是(12×2):(1×2)=12:1;
③根据2C2H2+5O2$\frac{\underline{\;点燃\;}}{\;}$4CO2+2H2O,则可知:反应前后,由于有单质参加反应,而碳元素的化合价发生改变;
④根据分析,R的化学式为:C2H2,则R的相对分子质量等于12×2+1×2=26.
故选D.
点评 本题要求掌握并理解各元素的相对原子质量的作用;求物质中各元素的比值,计算某分子的相对分子质量,求某物质中某元素的质量分数都是基本的计算.

练习册系列答案
相关题目
19.化学肥料对粮食增产起着重要作用,下列能作磷肥的是( )
| A. | NaNO3 | B. | K2SO4 | C. | CO(NH2)2 | D. | Ca(H2PO4)和CaSO4 |
16.下列除去杂质的方法中,不正确的是( )
| 选项 | 物质(括号内为杂质) | 除去杂质的方法 |
| A | NaOH溶液(Na2CO3) | 加入适量的Ca(OH)2溶液、过滤 |
| B | Fe(Cu) | 加足量稀硫酸后过滤 |
| C | CO(CO2) | 通过足量的NaOH溶液、干燥 |
| D | FeSO4溶液(H2SO4) | 加入足量Fe粉,过滤 |
| A. | A | B. | B | C. | C | D. | D |
13.有一包固体样品可能含有氢氧化钠、碳酸钠、硫酸钠、硝酸钡、硫酸铜中的一种或几种.
某化学兴趣小组为探究其成分做了以下实验:
Ⅰ.取少量固体于烧杯中,逐渐加水并不断搅拌至烧杯内固体不再溶解
Ⅱ.过滤,得到白色固体和无色清夜
Ⅲ.取少量清夜于试管中,滴加酚酞溶液,酚酞溶液不变色
请回答下列问题
(1)根据上述信息判断,该样品不可能含硫酸铜和氢氧化钠固体.
(2)提出合理假设,样品的成分有3种可能:
假设1:碳酸钠、硝酸钡 假设2:硫酸钠、硝酸钡 假设3:碳酸钠、硫酸钠、硝酸钡.
(3)为进一步探究固体样品的成分,该组同学取少量原固体于试管中.
限选试剂:稀盐酸、稀硫酸、稀硝酸、氯化钡溶液、蒸馏水
完成实验方案,请填写实验操作,与表中结论相符的预期现象.
某化学兴趣小组为探究其成分做了以下实验:
Ⅰ.取少量固体于烧杯中,逐渐加水并不断搅拌至烧杯内固体不再溶解
Ⅱ.过滤,得到白色固体和无色清夜
Ⅲ.取少量清夜于试管中,滴加酚酞溶液,酚酞溶液不变色
请回答下列问题
(1)根据上述信息判断,该样品不可能含硫酸铜和氢氧化钠固体.
(2)提出合理假设,样品的成分有3种可能:
假设1:碳酸钠、硝酸钡 假设2:硫酸钠、硝酸钡 假设3:碳酸钠、硫酸钠、硝酸钡.
(3)为进一步探究固体样品的成分,该组同学取少量原固体于试管中.
限选试剂:稀盐酸、稀硫酸、稀硝酸、氯化钡溶液、蒸馏水
完成实验方案,请填写实验操作,与表中结论相符的预期现象.
| 实验操作 | 预期现象 | 结论 |
| 步骤1: 取少量原固体样品于试管中,逐渐加水并不断搅拌至烧杯内固体不再溶解 | 有白色固体 | 假设1成立 |
| 步骤2: 向步骤1反应后的白色固体中滴加足量稀稀HNO3溶液,并不断震荡 | 白色固体完全溶解,有气泡产生 |
14.某学校化学小组的同学,取刚降地面的雨水样,用pH计(测pH的仪器)每隔几分钟测一次pH,其数据如表所示:
(1)绘制时间-pH关系图
(2)在测定的时间内,酸雨的酸性是增强(填“增强”或“减弱”)
(3)煤中含有的硫在燃烧时会以二氧化硫的形式排放,污染大气.
①硫在空气中燃烧的化学方程式是S+O2 $\frac{\underline{\;点燃\;}}{\;}$SO2.
②回收二氧化硫可以生成硫酸,化学方程式为2SO2+2H2O+O2═2H2SO4,参加反应的SO2与生成的H2SO4的质量比是32:49,将6.4t的SO2全部转化,可得到H2SO4的质量为9.8t.
| 定时间 | 5:05 | 5:10 | 5:15 | 5:20 | 5:25 | 5:30 | 5:35 |
| pH | 4.95 | 4.94 | 4.94 | 4.88 | 4.86 | 4.85 | 4.85 |

(2)在测定的时间内,酸雨的酸性是增强(填“增强”或“减弱”)
(3)煤中含有的硫在燃烧时会以二氧化硫的形式排放,污染大气.
①硫在空气中燃烧的化学方程式是S+O2 $\frac{\underline{\;点燃\;}}{\;}$SO2.
②回收二氧化硫可以生成硫酸,化学方程式为2SO2+2H2O+O2═2H2SO4,参加反应的SO2与生成的H2SO4的质量比是32:49,将6.4t的SO2全部转化,可得到H2SO4的质量为9.8t.
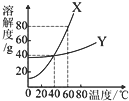 X、Y两种固体物质的溶解度曲线如图所示.回答下列问题
X、Y两种固体物质的溶解度曲线如图所示.回答下列问题