题目内容
12.连盐铁路是国家沿海铁路大通道的重要组成部分,也是实施江苏沿海开发国家战略的重要基础设施项目.预计2017年我县也将逐步跨入“高铁时代”如图1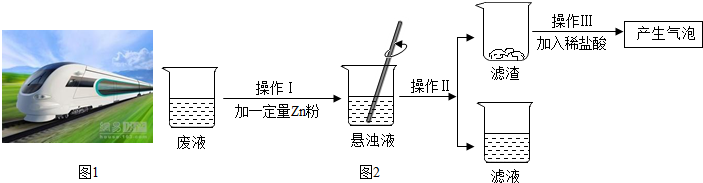
(1)钢轨建设需要大量的钢铁,钢铁是混合物(选填“纯净物”或“混合物”);属于金属(选填“金属”或“复合”)材料.
(2)工业炼铁的化学反应方程式是3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(3)铁生锈过程发生了复杂的化学反应,首先是铁与氧气,水反应生成氢氧化亚铁(Fe(OH)2),写出该反应的化学方程式2Fe+O2+2H2O=2Fe(OH)2,请写出生活中一种防止钢铁生锈的方法刷漆、涂油等.
(4)某电镀工厂的废墟中含有CuSO4和FeSO4同学们利用该废液进行了如图2的实验:
操作Ⅱ的名称是过滤;滤液中一定含有的溶质是ZnSO4(填化学式,下同);滤渣中一定含有的物质是Cu、Fe.
(5)将Fe2O3、ZnO的固体混合粉末ag,在高温条件下用足量CO还原,得到金属混合物2.42g,将生成的CO2用足量的澄清石灰水吸收后产生5.00g白色沉淀,则a的数值为3.22.
分析 (1)根据钢铁的组成分析.
(2)根据工业炼铁的原理写出化学反应方程式.
(3)根据铁与氧气,水反应生成氢氧化亚铁(Fe(OH)2),写出该反应的化学方程式,根据铁生锈的条件分析防锈的措施;
(4)根据金属与酸、盐的反应分析判断;
(5)根据反应方程式判断CO2中的O原子来源于CO和金属氧化物,计算出氧化物中氧元素的质量,金属氧化物的质量等于金属的质量加氧化物中氧元素的质量.
解答 解:(1)钢铁是混合物;属于金属材料.
(2)工业炼铁的化学反应方程式是:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(3)铁生锈过程发生了复杂的化学反应,首先是铁与氧气,水反应生成氢氧化亚铁(Fe(OH)2),该反应的化学方程式是:2Fe+O2+2H2O=2Fe(OH)2,生活中防止钢铁生锈的方法有很多,例如:刷漆、涂油等.
(4)由于锌、铁、铜三种金属的活动性是:锌>铁>铜,含有CuSO4和FeSO4的废液中加入一定量的锌粉,锌先与硫酸铜反应,当硫酸铜反应完全后,锌再与硫酸亚铁反应,操作Ⅱ能将固液分开,的名称是过滤由过滤后的滤渣加入稀盐酸有气泡生成,说明了有置换出的铁,铜全部置换出来了,所以,滤液中一定含有的溶质是ZnSO4;滤渣中一定含有的物质是Cu、Fe.
(5)设生成的二氧化碳的质量为x
CO2+Ca(OH)2═CaCO3↓+H20
44 100
x 5g
$\frac{44}{100}=\frac{x}{5g}$ 解得:x=2.2g
发生的有关反应为:Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2,ZnO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Zn+CO2,二氧化碳中碳元素的质量等于一氧化碳中碳元素的质量,故一氧化碳中碳元素质量为:2.2g×$\frac{12}{44}$=0.6g,一氧化碳中氧元素质量为0.6g×$\frac{16}{12}$=0.8g,二氧化碳中氧元素的质量为2.2g-0.6g=1.6g,从反应方程式可以看出,CO2中的O原子来源于CO和金属氧化物,故金属氧化物中氧元素的质量为1.6g-0.8g=0.8g,所以金属氧化物的质量为:2.42g+0.8g=3.22g,即a=3.22.
故答为:(1)混合物,金属;(2)3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;(3)2Fe+O2+2H2O=2Fe(OH)2刷漆、涂油等(4)过滤,ZnSO4,Cu、Fe;(5)3.22.
点评 本题通过连盐铁路,考查了金属材料、铁的冶炼、生锈集合防止生锈的措施、金属的活动性顺序表的应用等知识,难度不大,但涉及的知识点较多,应加强有关金属知识的学习.

| A. | 回收废旧电池,既可节约金属资源又可减少环境污染 | |
| B. | 用灼烧的方法区别棉花和羊毛 | |
| C. | 倡导低碳生活,就是杜绝使用化石燃料 | |
| D. | 使用可降解塑料代替传统塑料,有利于减轻“白色污染 |
| A. | 青蒿素属于氧化物 | |
| B. | 青蒿素中碳、氢、氧元素的质量比为15:22:5 | |
| C. | 青蒿素不属于有机化合物 | |
| D. | 青蒿素中氢元素的质量分数为7.8% |
| 营养成分:每100克产品中 | |
| 能量≥236千焦 | 蛋白质≥2.8克 |
| 脂肪≥2.9克 | 糖类≥3.4克 |
| 铁≥56毫克 | 钙≥93毫克 |
| A. | 不含油脂 | B. | 可补充钙元素和铁元素 | ||
| C. | 含有维生素C | D. | 100g该酸牛奶中可能含有3g糖 |
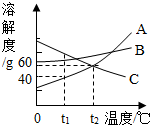 如图是A、B、C三种物质的溶解度曲线,下列说法错误的是( )
如图是A、B、C三种物质的溶解度曲线,下列说法错误的是( )| A. | t1℃时,A、B、C三种物质的溶解度由大到小的顺序是C>B>A | |
| B. | A可以采用冷却热饱和溶液的方法结晶 | |
| C. | t2℃时,A、C两种溶液的溶解度相等 | |
| D. | t2℃时,A、C两种溶液的溶质质量分数一定相等 |
| 选项 | 物质 | 所含杂质 | 除去杂质的方法 |
| A | NaOH | NaCl | 加入适量的稀盐酸 |
| B | FeCl2 | CuCl2 | 加入过量铁粉、充分反应后过滤 |
| C | KCl | MnO2 | 加水溶解、过滤、洗涤、干燥 |
| D | Na2SO4 | H2SO4 | 加过量的碳酸钠溶液 |
| A. | A | B. | B | C. | C | D. | D |
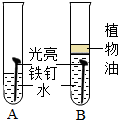 如图是某校初三(二)班阳光小组的同学们设计的探究铁制品锈蚀条件下的实验装置图,请你一起参与探究,并回答相关问题.
如图是某校初三(二)班阳光小组的同学们设计的探究铁制品锈蚀条件下的实验装置图,请你一起参与探究,并回答相关问题.