题目内容
“对比实验”是化学学习中行之有效的思维方法.某化学学习小组的同学在学完相关的化学知识后,走进实验室做了如下实验,请你参与并回答下列问题.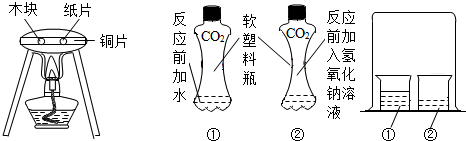
A.燃烧的条件 B. 证明CO2与NaOH反应 C.分子运动的现象
(1)实验A中,在铜片上分别放置木块和纸片,通过实验可以说明燃烧的条件之一是
(2)实验B是利用体积相同并充满CO2的软塑料瓶、等量的水(瓶①)和NaOH溶液
(瓶②)进行实验,根据塑料瓶变瘪的程度证明CO2 与NaOH溶液中的溶质确实发生了反应,这一反应的化学方程式为
(3)实验C是通过烧杯②中呈现的现象来说明分子是不断运动的.当烧杯①中液体是浓盐酸时,烧杯②中的石蕊溶液由紫色变为 色;当烧杯②中液体换成滴有酚酞的NaOH溶液时,一段时间后,溶液颜色的变化是 .其中盐酸与NaOH反应的化学方程式为 .

A.燃烧的条件 B. 证明CO2与NaOH反应 C.分子运动的现象
(1)实验A中,在铜片上分别放置木块和纸片,通过实验可以说明燃烧的条件之一是
(2)实验B是利用体积相同并充满CO2的软塑料瓶、等量的水(瓶①)和NaOH溶液
(瓶②)进行实验,根据塑料瓶变瘪的程度证明CO2 与NaOH溶液中的溶质确实发生了反应,这一反应的化学方程式为
(3)实验C是通过烧杯②中呈现的现象来说明分子是不断运动的.当烧杯①中液体是浓盐酸时,烧杯②中的石蕊溶液由紫色变为
考点:燃烧与燃烧的条件,碱的化学性质,分子的定义与分子的特性,书写化学方程式、文字表达式、电离方程式
专题:实验性简答题
分析:(1)根据燃烧的条件进行解答;
(2)根据二氧化碳和NaOH溶液反应生成碳酸钠和水进行解答;
(3)根据浓盐酸、浓氨水具有挥发性以及酸碱指示剂遇到酸碱变色情况进行解答.
(2)根据二氧化碳和NaOH溶液反应生成碳酸钠和水进行解答;
(3)根据浓盐酸、浓氨水具有挥发性以及酸碱指示剂遇到酸碱变色情况进行解答.
解答:解:(1)燃烧的条件:物质具有可燃性、与氧气接触、温度达到可燃物的着火点,通过试验A,可以说明燃烧的条件之一是温度达到可燃物的着火点;(2)二氧化碳和NaOH溶液反应生成碳酸钠和水,反应的化学方程式为2NaOH+CO2═Na2CO3+H2O;
(3)实验C的烧杯②中呈现的现象能说明分子是不断运动的.当烧杯①中液体是浓盐酸时,浓盐酸具有挥发性,挥发出的盐酸溶于水呈酸性,所以烧杯②中的石蕊溶液由紫色变为红色;
烧杯②中液体换成滴有酚酞NaOH溶液时,一段时间后,溶液颜色的变化是红色逐渐褪去变为无色.其中盐酸与NaOH反应生成氯化钠和水,反应的化学方程式为HCl+NaOH═NaCl+H2O.
故答案为:(1)温度达到可燃物的着火点;
(2)2NaOH+CO2═Na2CO3+H2O;
(3)红;红色逐渐褪去变为无色;HCl+NaOH═NaCl+H2O.
(3)实验C的烧杯②中呈现的现象能说明分子是不断运动的.当烧杯①中液体是浓盐酸时,浓盐酸具有挥发性,挥发出的盐酸溶于水呈酸性,所以烧杯②中的石蕊溶液由紫色变为红色;
烧杯②中液体换成滴有酚酞NaOH溶液时,一段时间后,溶液颜色的变化是红色逐渐褪去变为无色.其中盐酸与NaOH反应生成氯化钠和水,反应的化学方程式为HCl+NaOH═NaCl+H2O.
故答案为:(1)温度达到可燃物的着火点;
(2)2NaOH+CO2═Na2CO3+H2O;
(3)红;红色逐渐褪去变为无色;HCl+NaOH═NaCl+H2O.
点评:此题是一道实验设计题,解题的关键是掌握燃烧的条件、二氧化碳的性质、微粒的性质并进行知识的大胆迁移,只有这样才能顺利解题.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
下列说法中正确的是( )
| A、分子都是由原子构成的 |
| B、分子和原子的主要区别是分子能分成原子,而原子不能再分 |
| C、氧气由氧原子构成 |
| D、汞由汞分子构成 |
根据如图的有关信息判断,下列说法错误的是( )


| A、氯元素的核电荷数为17 |
| B、钠的原子结构示意图中X=8 |
| C、钠原子的中子数为11 |
| D、在化学反应中,钠原子容易失去1个电子 |
 用紫色石蕊试液将滤纸染成紫色,经烘干后做成两朵干燥紫色小花.如图,先取一朵直接放入盛有二氧化碳的集气瓶中,再取另一朵喷上水后再放入盛有二氧化碳的集气瓶中.
用紫色石蕊试液将滤纸染成紫色,经烘干后做成两朵干燥紫色小花.如图,先取一朵直接放入盛有二氧化碳的集气瓶中,再取另一朵喷上水后再放入盛有二氧化碳的集气瓶中. 亮亮同学对课本上的有关实验(如图)有几个疑问.请你发挥自己的聪明才智为他解答以下问题:
亮亮同学对课本上的有关实验(如图)有几个疑问.请你发挥自己的聪明才智为他解答以下问题:
