题目内容
(2009?上海一模)现有下列短周期元素性质的有关数据:
(1)根据元素周期律确定a至j十种元素在周期表中的位置,将它们的元素编号填入下表相应的空格内.
(2)上述10种元素形成的氢化物中,分子间存在氢键的有(填氢化物的化学式)
(3)i在b的氧化物中燃烧的方程式为
(4)h和d所形成的化合物的电子式为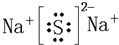
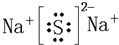 .
.
(5)原子数相同,电子总数相同的分子或离子互称等电子体.在元素周期表中,与碳相邻的两种元素可形成具有石墨型晶体结构的“白石墨”,“白石墨”和石墨具有等电子体特征,画出“白石墨”的最小结构单元的结构式
 .
.
| 元素编号 | a | b | c | d | e | f | g | h | i | j |
| 原子半径/pm | 111 | 77 | 70 | 104 | 143 | 99 | 117 | 186 | 160 | 64 |
| 最高化合价或 最低化合价 |
+2 | -4 | -3 | +6 | +3 | -1 | +4 | +1 | +2 | -1 |
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ||||||||
| 2 | a a |
b b |
c c |
j j |
||||
| 3 | h h |
i i |
e e |
g g |
d d |
f f |
||
HF、NH3
HF、NH3
.(3)i在b的氧化物中燃烧的方程式为
2Mg+CO2
2MgO+C
| ||
2Mg+CO2
2MgO+C
.
| ||
(4)h和d所形成的化合物的电子式为
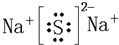
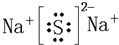
(5)原子数相同,电子总数相同的分子或离子互称等电子体.在元素周期表中,与碳相邻的两种元素可形成具有石墨型晶体结构的“白石墨”,“白石墨”和石墨具有等电子体特征,画出“白石墨”的最小结构单元的结构式


分析:1、根据短周期元素、元素周期律(同一周期,元素的原子半径随着原子序数的增大而减小;同一主族,元素的原子半径随着原子序数的增大而增大.主族元素的最高价=其族序数=价电子数,主族元素的最低负价=其族序数-8),判断这些元素在周期表中的位置.
2、利用学过的化学用语、概念(氢键、电子式、化学方程式)进行解题.
3、对于信息给予题,要充分利用电子体、碳相邻的两种元素可形成具有石墨型晶体结构、白石墨”和石墨具有等电子体特征这些信息,把C原子换成N、B原子即可.
2、利用学过的化学用语、概念(氢键、电子式、化学方程式)进行解题.
3、对于信息给予题,要充分利用电子体、碳相邻的两种元素可形成具有石墨型晶体结构、白石墨”和石墨具有等电子体特征这些信息,把C原子换成N、B原子即可.
解答:解:(1)、根据短周期元素、元素周期律确定a至j十种元素在周期表中的位置.根据主族元素的最高价=其族序数=价电子数,主族元素的最低负价=其族序数-8)判断,a至j十种元素在周期表分别属于ⅡA、ⅣA、ⅤA、ⅥA、ⅢA、ⅦA、ⅣA、ⅠA、ⅡA、ⅦA.再根据同一主族,元素的原子半径随着原子序数的增大而增大,a至j十种元素属于第二周期的为:a、b、c、j,属于第三周期的为:h、i、e、g、d、f.所以本题的答案为:
(2)、形成氢键的分子,既要有较易提供H原子的分子,还要具有孤电子对,而且电负性比较强、原子半径又不太大的原子作为电子对的供体.因此,可以具有较强氢键的元素是F、O、N三种元素,本题中只有F、N元素,所以本题的答案为:
HF、NH3.
(3)、通过(1)题确定i为Mg 元素,b是C元素,C的氧化物是CO2,Mg能够在CO2中燃烧,产物是白色的固体MgO和黑色的固体C,所以本题的答案为:2Mg+CO2
2MgO+C.
(4)、通过(1)知道,h处于第三周期第一ⅠA族是Na元素,d处于第三周期第ⅥA族是S元素,Na元素与S元素形成的化合物为离子化合物,形成的键位离子键.书写时原子少的放中间,原子多的放周边,阳离子只写元素符号,右上角标出电荷和电性,阴离子要有中括号括起来,然后在右上角标出电荷和电性,所以本题答案为: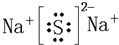
(5)、石墨晶体是层面结构的,每个C为三个正六边形共用,每六个C原子形成一个正六边形,碳相邻的N、B两种元素可形成具有石墨型晶体结构,所以白石墨的最小结构单元的结构式为:正六边形,且三个N原子三个B原子相互间隔分布在每个顶点上 .
.
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ||||||||
| 2 | a | b | c | j | ||||
| 3 | h | i | e | g | d | f | ||
HF、NH3.
(3)、通过(1)题确定i为Mg 元素,b是C元素,C的氧化物是CO2,Mg能够在CO2中燃烧,产物是白色的固体MgO和黑色的固体C,所以本题的答案为:2Mg+CO2
| ||
(4)、通过(1)知道,h处于第三周期第一ⅠA族是Na元素,d处于第三周期第ⅥA族是S元素,Na元素与S元素形成的化合物为离子化合物,形成的键位离子键.书写时原子少的放中间,原子多的放周边,阳离子只写元素符号,右上角标出电荷和电性,阴离子要有中括号括起来,然后在右上角标出电荷和电性,所以本题答案为:
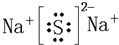
(5)、石墨晶体是层面结构的,每个C为三个正六边形共用,每六个C原子形成一个正六边形,碳相邻的N、B两种元素可形成具有石墨型晶体结构,所以白石墨的最小结构单元的结构式为:正六边形,且三个N原子三个B原子相互间隔分布在每个顶点上
 .
.点评:1、本题考查的是元素周期律的灵活运用以及一些化学用语.
2、对于信息给予题,要充分利用给予的信息,调用与这些信息相关的旧知识,使之与所给信息结合,形成解答习题的知识基础,然后依照葫芦画瓢.
3、元素周期律、元素周期表是高考的必考内容,该考点知 识内容丰富,规律性强,因此命题的空间极为广阔.要利用元素周期表解题,就要熟悉元素周期表的结构,元素在周期表中的位置,特别是短周期元素要熟练掌握,然后根据同周期、同主族元素性质的相似性和递变性推断、判定.
2、对于信息给予题,要充分利用给予的信息,调用与这些信息相关的旧知识,使之与所给信息结合,形成解答习题的知识基础,然后依照葫芦画瓢.
3、元素周期律、元素周期表是高考的必考内容,该考点知 识内容丰富,规律性强,因此命题的空间极为广阔.要利用元素周期表解题,就要熟悉元素周期表的结构,元素在周期表中的位置,特别是短周期元素要熟练掌握,然后根据同周期、同主族元素性质的相似性和递变性推断、判定.

练习册系列答案
相关题目