题目内容
I.在过氧化氢中加入乙醚后,再加入数滴K2Cr2O7的硫酸溶液,轻轻振荡后静置,乙醚层呈蓝色,这是由于生成的过氧化铬(CrO5)溶于乙醚的缘故.已知过氧化铬的结构简式为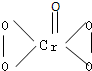 ?
?
(1)CrO5中氧元素的化合价为
(2)上述反应的离子方程式为
Ⅱ.下表是元素周期表的一部分,表中所列字母分别代表某一化学元素.
(1)i元素名称是
(2)NH3?H2O的电离方程式为NH3?H2O?NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是
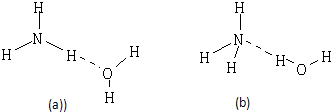
(3)用电子式表示e的过氧化物的形成过程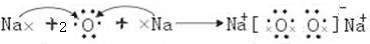
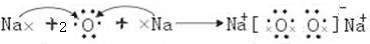 .
.
(4)利用稀有气体化合物,人们实现了许多制备实验上的突破.如XeO3在一定条件下与NaBrO3反应生成NaBrO4,同时放出Xe.写出上述反应方程式:
 ?
?(1)CrO5中氧元素的化合价为
一个O为-2价、4个O为-1价
一个O为-2价、4个O为-1价
.(2)上述反应的离子方程式为
Cr2O72-+4H2O2+2H+=2CrO5+5H2O
Cr2O72-+4H2O2+2H+=2CrO5+5H2O
.Ⅱ.下表是元素周期表的一部分,表中所列字母分别代表某一化学元素.
| a | b | ||||||||||||||||
| c | d | ||||||||||||||||
| e | f | g | h | ||||||||||||||
| i | j | ||||||||||||||||
锡
锡
.(2)NH3?H2O的电离方程式为NH3?H2O?NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是
(b)
(b)
.(填序号)
(3)用电子式表示e的过氧化物的形成过程
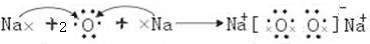
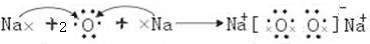
(4)利用稀有气体化合物,人们实现了许多制备实验上的突破.如XeO3在一定条件下与NaBrO3反应生成NaBrO4,同时放出Xe.写出上述反应方程式:
XeO3+3NaBrO3=3NaBrO4+Xe
XeO3+3NaBrO3=3NaBrO4+Xe
.分析:I.(1)根据过氧化铬的结构简式可知存在过氧键、Cr-O键、Cr=O来分析;
(2)过氧化氢与K2Cr2O7在酸性溶液中发生反应生成CrO5和水;
Ⅱ.(1)i在元素周期表中第五周期第ⅣA族;
(2)O元素的电负性大于N元素的电负性,以此分析;
(3)e为Na,则过氧化物为离子化合物;
(4)由XeO3在一定条件下与NaBrO3反应生成NaBrO4,同时放出Xe,则可知反应物与生成物,进一步书写化学反应方程式.
(2)过氧化氢与K2Cr2O7在酸性溶液中发生反应生成CrO5和水;
Ⅱ.(1)i在元素周期表中第五周期第ⅣA族;
(2)O元素的电负性大于N元素的电负性,以此分析;
(3)e为Na,则过氧化物为离子化合物;
(4)由XeO3在一定条件下与NaBrO3反应生成NaBrO4,同时放出Xe,则可知反应物与生成物,进一步书写化学反应方程式.
解答:解:I.(1)根据过氧化铬的结构简式可知存在过氧键、Cr-O键、Cr=O,在4个Cr-O键中O为-1价,在Cr=O键注重O为-2价,故答案为:一个O为-2价、4个O为-1价;
(2)过氧化氢与K2Cr2O7在酸性溶液中发生反应生成CrO5和水,离子反应为Cr2O72-+4H2O2+2H+=2CrO5+5H2O,
故答案为:Cr2O72-+4H2O2+2H+=2CrO5+5H2O;
Ⅱ.(1)i在元素周期表中第五周期第ⅣA族,则i为锡,故答案为:锡;
(2)O元素的电负性大于N元素的电负性,则水中的H原子为裸露的质子,则形成的NH3?H2O的合理结构为(b),
故答案为:(b);
(3)e为Na,则过氧化物为离子化合物,过氧化钠的形成过程为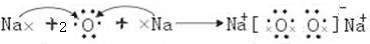 ,
,
故答案为: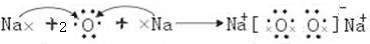 ;
;
(4)由XeO3在一定条件下与NaBrO3反应生成NaBrO4,同时放出Xe,则化学反应方程式为,
故答案为:XeO3+3NaBrO3=3NaBrO4+Xe.
(2)过氧化氢与K2Cr2O7在酸性溶液中发生反应生成CrO5和水,离子反应为Cr2O72-+4H2O2+2H+=2CrO5+5H2O,
故答案为:Cr2O72-+4H2O2+2H+=2CrO5+5H2O;
Ⅱ.(1)i在元素周期表中第五周期第ⅣA族,则i为锡,故答案为:锡;
(2)O元素的电负性大于N元素的电负性,则水中的H原子为裸露的质子,则形成的NH3?H2O的合理结构为(b),
故答案为:(b);
(3)e为Na,则过氧化物为离子化合物,过氧化钠的形成过程为
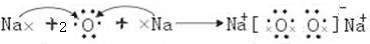 ,
,故答案为:
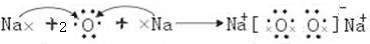 ;
;(4)由XeO3在一定条件下与NaBrO3反应生成NaBrO4,同时放出Xe,则化学反应方程式为,
故答案为:XeO3+3NaBrO3=3NaBrO4+Xe.
点评:本题考查元素周期表及元素周期律、化学键、化学反应方程式的书写等,学生注意利用信息和所学知识结合即可解答,难度不大.

练习册系列答案
相关题目
I.在过氧化氢中加入乙醚后,再加入数滴K2Cr2O7的硫酸溶液,轻轻振荡后静置,乙醚层呈蓝色,这是由于生成的过氧化铬(CrO5)溶于乙醚的缘故.已知过氧化铬的结构简式为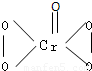 ?
?
(1)CrO5中氧元素的化合价为 .
(2)上述反应的离子方程式为 .
Ⅱ.下表是元素周期表的一部分,表中所列字母分别代表某一化学元素.
(1)i元素名称是 .
(2)NH3?H2O的电离方程式为NH3?H2O?NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是 .(填序号)
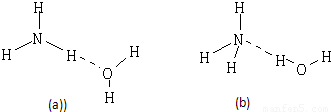
(3)用电子式表示e的过氧化物的形成过程 .
(4)利用稀有气体化合物,人们实现了许多制备实验上的突破.如XeO3在一定条件下与NaBrO3反应生成NaBrO4,同时放出Xe.写出上述反应方程式: .
 ?
?(1)CrO5中氧元素的化合价为 .
(2)上述反应的离子方程式为 .
Ⅱ.下表是元素周期表的一部分,表中所列字母分别代表某一化学元素.
| a | b | ||||||||||||||||
| c | d | ||||||||||||||||
| e | f | g | h | ||||||||||||||
| i | j | ||||||||||||||||
(2)NH3?H2O的电离方程式为NH3?H2O?NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是 .(填序号)

(3)用电子式表示e的过氧化物的形成过程 .
(4)利用稀有气体化合物,人们实现了许多制备实验上的突破.如XeO3在一定条件下与NaBrO3反应生成NaBrO4,同时放出Xe.写出上述反应方程式: .

