题目内容
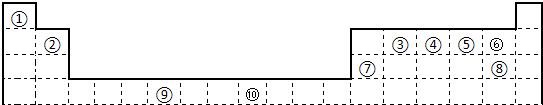
下表为长式周期表的一部分,其中的编号代表对应的元素.
试填空.
(1)写出上表中元素D形成单质的电子式为
 ;
;
(2)元素K基态原子的电子排布式
 ;元素D原子核外的电子占有的轨道数目为
;元素D原子核外的电子占有的轨道数目为
(3)元素M位于周期表的第
(4)G、H、I 这三种元素的第一电离能由大到小的顺序是
(5)元素A、D、J按照原子个数比4:1:1形成的化合物的化学式为
(6)A、C、D 形成的ACD分子中,含有
(7)E、F、G、H这四种元素原子形成的简单阴、阳离子,按半径由小到大排列
(8)某些不同族元素的性质也有一定的相似性,如上表中元素B与元素I的氢氧化物有相似的性质,写出元素B的氢氧化物与NaOH溶液反应后盐的化学式
(9)元素L在一定条件下形成的晶体的基本结构单元如图1和图2所示,则在图1和图2的结构中与该元素一个原子等距离且最近的原子数之比为:

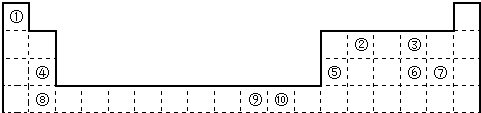
| A | |||||||||||||||||
| B | C | D | E | F | |||||||||||||
| G | H | I | J | ||||||||||||||
| K | M | L |
(1)写出上表中元素D形成单质的电子式为


(2)元素K基态原子的电子排布式
[Ar]3d54s1
[Ar]3d54s1
;H元素的离子结构示意图

5
5
个.(3)元素M位于周期表的第
ⅤⅢ
ⅤⅢ
族;当将M单质与酸性KMnO4溶液作用时,1个M原子失去3个电子,这些电子分别是在4s、3d
4s、3d
轨道上的;(4)G、H、I 这三种元素的第一电离能由大到小的顺序是
Mg>Al>Na
Mg>Al>Na
(填对应的元素符号);三种元素最高价氧化物对应水化物的碱性由强到弱排列NaOH>Mg(OH)2>Al(OH)3
NaOH>Mg(OH)2>Al(OH)3
(填对应的化学式).(5)元素A、D、J按照原子个数比4:1:1形成的化合物的化学式为
NH4Cl
NH4Cl
,其形成的晶体中含有的化学键类型为离子键和共价键、配位键
离子键和共价键、配位键
.(写出化学键最具体的类别)(6)A、C、D 形成的ACD分子中,含有
2
2
个σ键,2
2
个π键.(7)E、F、G、H这四种元素原子形成的简单阴、阳离子,按半径由小到大排列
Mg2+<Na+<F-<O2-
Mg2+<Na+<F-<O2-
(填对应的离子符号)(8)某些不同族元素的性质也有一定的相似性,如上表中元素B与元素I的氢氧化物有相似的性质,写出元素B的氢氧化物与NaOH溶液反应后盐的化学式
Na2BeO2
Na2BeO2
.(9)元素L在一定条件下形成的晶体的基本结构单元如图1和图2所示,则在图1和图2的结构中与该元素一个原子等距离且最近的原子数之比为:
2:3
2:3
.两种晶胞中实际含有原子个数之比为1:2
1:2
.
分析:(1)D为N,最外层有5个电子;
(2)K为Cr,原子序数为24,H为Mg,原子序数为12,D原子核外的电子占1s、2s及3p的3个轨道;
(3)M为Fe,原子序数为26,1个M原子失去3个电子,为4s、3d电子;
(4)G、H、I分别为Na、Mg、Al,金属性越强,第一电离能越小,但Mg的3s全满为稳定结构;金属性越强,最高价氧化物对应水化物的碱性越强;
(5)A、D、J按照原子个数比4:1:1形成的化合物为NH4Cl;
(6)ACD分子为H-C≡N;
(7)E、F、G、H这四种元素原子形成的简单阴、阳离子,具有相同的电子排布,原子序数大的离子半径小;
(8)B为Be,与Al性质相似;
(9)由图1可知,与体心原子距离最近的原子位于顶点,则有8个;由图2可知,与顶点原子距离最近的原子位于面心,1个晶胞中有3个,则晶体中有
=12个;图1中原子为1+8×
=2个,图2中原子为8×
+6×
=4个.
(2)K为Cr,原子序数为24,H为Mg,原子序数为12,D原子核外的电子占1s、2s及3p的3个轨道;
(3)M为Fe,原子序数为26,1个M原子失去3个电子,为4s、3d电子;
(4)G、H、I分别为Na、Mg、Al,金属性越强,第一电离能越小,但Mg的3s全满为稳定结构;金属性越强,最高价氧化物对应水化物的碱性越强;
(5)A、D、J按照原子个数比4:1:1形成的化合物为NH4Cl;
(6)ACD分子为H-C≡N;
(7)E、F、G、H这四种元素原子形成的简单阴、阳离子,具有相同的电子排布,原子序数大的离子半径小;
(8)B为Be,与Al性质相似;
(9)由图1可知,与体心原子距离最近的原子位于顶点,则有8个;由图2可知,与顶点原子距离最近的原子位于面心,1个晶胞中有3个,则晶体中有
| 3×8 |
| 2 |
| 1 |
| 8 |
| 1 |
| 8 |
| 1 |
| 2 |
解答:解:(1)D为N,最外层有5个电子,氮气的电子式为 ,故答案为:
,故答案为: ;
;
(2)K为Cr,原子序数为24,基态原子的电子排布式为[Ar]3d54s1,H为Mg,原子序数为12,离子结构示意图为 ,D原子核外的电子占1s、2s及3p的3个轨道,共5个轨道,故答案为:[Ar]3d54s1;
,D原子核外的电子占1s、2s及3p的3个轨道,共5个轨道,故答案为:[Ar]3d54s1; ;5;
;5;
(3)M为Fe,原子序数为26,位于第ⅤⅢ族,反应中1个M原子失去3个电子,为4s、3d电子,故答案为:ⅤⅢ;4s、3d;
(4)G、H、I分别为Na、Mg、Al,金属性越强,第一电离能越小,但Mg的3s全满为稳定结构,则第一电离能为Mg>Al>Na;金属性越强,最高价氧化物对应水化物的碱性越强,碱性为NaOH>Mg(OH)2>Al(OH)3,故答案为:Mg>Al>Na;NaOH>Mg(OH)2>Al(OH)3;
(5)A、D、J按照原子个数比4:1:1形成的化合物为NH4Cl,含离子键和共价键,故答案为:NH4Cl;离子键和共价键、配位键;
(6)ACD分子为H-C≡N,含有2个σ键,2个π键,故答案为:2;2;
(7)E、F、G、H这四种元素原子形成的简单阴、阳离子,具有相同的电子排布,原子序数大的离子半径小,则离子半径为Mg2+<Na+<F-<O2-,
故答案为:Mg2+<Na+<F-<O2-;
(8)B为Be,与Al性质相似则Be与NaOH溶液反应生成Na2BeO2,故答案为:Na2BeO2;
(9)由图1可知,与体心原子距离最近的原子位于顶点,则有8个;由图2可知,与顶点原子距离最近的原子位于面心,1个晶胞中有3个,空间有8个晶胞无隙并置,且1个面被2个晶胞共用,则晶体中有
=12个,所以在图1和图2的结构中与该元素一个原子等距离且最近的原子数之比为8:12=2:3,图1中原子为1+8×
=2个,图2中原子为8×
+6×
=4个,两种晶胞中实际含有原子个数之比为2:4=1:2,故答案为:2:3;1:2.
 ,故答案为:
,故答案为: ;
;(2)K为Cr,原子序数为24,基态原子的电子排布式为[Ar]3d54s1,H为Mg,原子序数为12,离子结构示意图为
 ,D原子核外的电子占1s、2s及3p的3个轨道,共5个轨道,故答案为:[Ar]3d54s1;
,D原子核外的电子占1s、2s及3p的3个轨道,共5个轨道,故答案为:[Ar]3d54s1; ;5;
;5;(3)M为Fe,原子序数为26,位于第ⅤⅢ族,反应中1个M原子失去3个电子,为4s、3d电子,故答案为:ⅤⅢ;4s、3d;
(4)G、H、I分别为Na、Mg、Al,金属性越强,第一电离能越小,但Mg的3s全满为稳定结构,则第一电离能为Mg>Al>Na;金属性越强,最高价氧化物对应水化物的碱性越强,碱性为NaOH>Mg(OH)2>Al(OH)3,故答案为:Mg>Al>Na;NaOH>Mg(OH)2>Al(OH)3;
(5)A、D、J按照原子个数比4:1:1形成的化合物为NH4Cl,含离子键和共价键,故答案为:NH4Cl;离子键和共价键、配位键;
(6)ACD分子为H-C≡N,含有2个σ键,2个π键,故答案为:2;2;
(7)E、F、G、H这四种元素原子形成的简单阴、阳离子,具有相同的电子排布,原子序数大的离子半径小,则离子半径为Mg2+<Na+<F-<O2-,
故答案为:Mg2+<Na+<F-<O2-;
(8)B为Be,与Al性质相似则Be与NaOH溶液反应生成Na2BeO2,故答案为:Na2BeO2;
(9)由图1可知,与体心原子距离最近的原子位于顶点,则有8个;由图2可知,与顶点原子距离最近的原子位于面心,1个晶胞中有3个,空间有8个晶胞无隙并置,且1个面被2个晶胞共用,则晶体中有
| 3×8 |
| 2 |
| 1 |
| 8 |
| 1 |
| 8 |
| 1 |
| 2 |
点评:本题考查位置、结构、性质的关系及应用,元素的推断是解答的关键,侧重原子结构与性质的考查,涉及知识点较多,把握选修3的知识即可,题目难度中等.

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目