��Ŀ����
 �±�Ϊ���ֶ�����Ԫ�ػ��ϼۼ�����Ӧԭ�Ӱ뾶�����ݣ���ش��������⣺
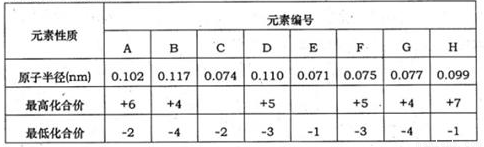
�±�Ϊ���ֶ�����Ԫ�ػ��ϼۼ�����Ӧԭ�Ӱ뾶�����ݣ���ش��������⣺| Ԫ������ | Ԫ�ر�� | |||||||
| A | B | C | D | E | F | G | H | |
| ԭ�Ӱ뾶��nm�� | 0.102 | 0.117 | 0.074 | 0.110 | 0.071 | 0.075 | 0.077 | 0.099 |
| ����ϼ� | +6 | +4 | +5 | +5 | +4 | +7 | ||
| ��ͻ��ϼ� | -2 | -4 | -2 | -3 | -1 | -3 | -4 | -1 |
��2��A��B��C��E���⻯���ȶ���˳����
��3���������ΪACH2��������ˮ�л�ǿ��ˮ�⣬����ʹƷ����Һ��ɫ����ɫ�����һ��ǿ�ᣮ�÷�Ӧ�Ļ�ѧ����ʽ��
��4����д��B�ĵ��ʵ�һ����Ҫ��;
��5�������һ��ʵ�鷽����ʹͭ��A������������Ӧ��ˮ�����ϡ��Һ��Ӧ���õ���ɫ��Һ��������������ͼ�����ڻ����ʵ�鷽��ԭ��װ��ʾ��ͼ��
������������Ԫ�أ�A��C����ͻ��ϼ�-2�����ڵڢ�A�壬A����ϼ�+6����Aԭ�Ӱ뾶�ϴ�AΪSԪ�أ�CΪOԪ�أ�B��G�����������+4�������-4�����ڢ�A�壬B��ԭ�Ӱ뾶�ϴ���BΪSi��GΪ̼Ԫ�أ�D��F�����������+5�������-3�����ڢ�A�壬D��ԭ�Ӱ뾶�ϴ���FΪPԪ�ء�FΪNԪ�أ�E��H������ͻ��ϼ�-1�����ڢ�A�壬H����������ϼ�+7����ԭ�Ӱ뾶�ϴ���EΪFԪ�ء�HΪClԪ�أ��ݴ˽��
����⣺������Ԫ�أ�A��C����ͻ��ϼ�-2�����ڵڢ�A�壬A����ϼ�+6����Aԭ�Ӱ뾶�ϴ�AΪSԪ�أ�CΪOԪ�أ�B��G�����������+4�������-4�����ڢ�A�壬B��ԭ�Ӱ뾶�ϴ���BΪSi��GΪ̼Ԫ�أ�D��F�����������+5�������-3�����ڢ�A�壬D��ԭ�Ӱ뾶�ϴ���FΪPԪ�ء�FΪNԪ�أ�E��H������ͻ��ϼ�-1�����ڢ�A�壬H����������ϼ�+7����ԭ�Ӱ뾶�ϴ���EΪFԪ�ء�HΪClԪ�أ�
��1��GΪ̼Ԫ�أ��������е�λ���ǣ��ڶ����ڢ�A�壻Ԫ��F���γɵij�������ΪN2�������ʽΪ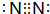 ��
��
�ʴ�Ϊ���ڶ����ڢ�A�壻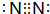 ��
��
��2���ǽ�����F��O��S��Si������⻯���ȶ���˳����HF��H2O��H2S��SiH4��
�ʴ�Ϊ��HF��H2O��H2S��SiH4��
��3��SOCl2��ˮ�л�ǿ��ˮ�⣬����ʹƷ����Һ��ɫ����ɫ�����һ��ǿ�ᣬ������SO2��HCl���÷�Ӧ�Ļ�ѧ����ʽ��SOCl2+H2O=SO2��+2HCl��
�ʴ�Ϊ��SOCl2+H2O=SO2��+2HCl��
��4���赥�ʿ��������뵼����ϡ�����Ͻ𡢹��صȣ���ҵ����ȡ��ķ�ӦΪSiO2+2C
Si+2CO����
�ʴ�Ϊ�������뵼����ϡ�����Ͻ𡢹��صȣ�SiO2+2C
Si+2CO����
��5��ʹͭ��H2SO4��ϡ��Һ��Ӧ���õ���ɫ��Һ��������ӦΪ���أ�Cu�����ص����������ӵ�Դ�������������Ϊϡ���ᣬ����Ϊʯī�ȣ�װ��ͼΪ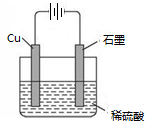 ��
��
�ʴ�Ϊ�� ��
��
��1��GΪ̼Ԫ�أ��������е�λ���ǣ��ڶ����ڢ�A�壻Ԫ��F���γɵij�������ΪN2�������ʽΪ
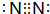 ��
���ʴ�Ϊ���ڶ����ڢ�A�壻
 ��
����2���ǽ�����F��O��S��Si������⻯���ȶ���˳����HF��H2O��H2S��SiH4��
�ʴ�Ϊ��HF��H2O��H2S��SiH4��
��3��SOCl2��ˮ�л�ǿ��ˮ�⣬����ʹƷ����Һ��ɫ����ɫ�����һ��ǿ�ᣬ������SO2��HCl���÷�Ӧ�Ļ�ѧ����ʽ��SOCl2+H2O=SO2��+2HCl��
�ʴ�Ϊ��SOCl2+H2O=SO2��+2HCl��
��4���赥�ʿ��������뵼����ϡ�����Ͻ𡢹��صȣ���ҵ����ȡ��ķ�ӦΪSiO2+2C
| ||
�ʴ�Ϊ�������뵼����ϡ�����Ͻ𡢹��صȣ�SiO2+2C
| ||
��5��ʹͭ��H2SO4��ϡ��Һ��Ӧ���õ���ɫ��Һ��������ӦΪ���أ�Cu�����ص����������ӵ�Դ�������������Ϊϡ���ᣬ����Ϊʯī�ȣ�װ��ͼΪ
 ��
���ʴ�Ϊ��
 ��
�����������⿼�����ʽṹλ�ù�ϵӦ�ã��漰����ʽ����ѧ����ʽ�ȳ��û�ѧ���Ԫ�������ɡ����ԭ���ȣ��Ѷ��еȣ�ע�����û��ϼ���뾶ȷ��Ԫ���ǽ���ؼ���ע�⣨5���ж�ѧ����ͼ�����Ŀ��飮

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ