摘要:②a―氢()表现出一定的酸性.能与碱作用产生碳负离子,. (1)醛与亚硫酸氢钠加成反应的过程如下:
网址:http://m.1010jiajiao.com/timu_id_499180[举报]
1.B 2.B 3.B 4.B 5.A 6.BD 7.A 8.A 9.AD 10.A 11.AD
12.CD 13.C 14.A 15.B 16.D 17.D 18.C 19.A 20.B 21.A 22.B
23.(1)E、 、
、 (2)D、
(2)D、 、
、 (3)A、
(3)A、 、
、 (4)D、
(4)D、 、
、 .
.
24.①
②
③
④
25.(1)磺酸基 H亦有较强的酸性
H亦有较强的酸性 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
(2)A  (3)
(3)

26.(1) (2)
(2) (3)②⑤
(3)②⑤
(4)
n 

(2)①

②

(2)①②③④
29.


(2)可以,因为该反应的总反应式为 ,原子利用率=34/34×100%=100%,故可称为理想状态
,原子利用率=34/34×100%=100%,故可称为理想状态
30.(1)A、D (2)除去过量的硫粉 (3)
(4) 生成
生成 :
: ,∴ 未饱和
,∴ 未饱和
(5)B (6)设析出的晶体质量为x(g)
30×1.14-18.9=15.3(g) 
∴ x=23.1(g) www.ks5u.com
www.ks5u.com
(Ⅰ)实验室中盐酸的用途十分广泛,常常用来制备气体.
(1)某小组同学欲用4mol/L的盐酸配制230mL 0.4mol/L 盐酸溶液,需取用4mol/L盐酸
(2)下列实验操作使配制的溶液浓度偏低的是
A.容量瓶洗涤后未干燥
B.移液时,有少量溶液溅出
C.定容时,加水不慎超过刻度线,又倒出一些
D.定容时,俯视刻度线
E.装入试剂瓶时,有少量溶液溅出
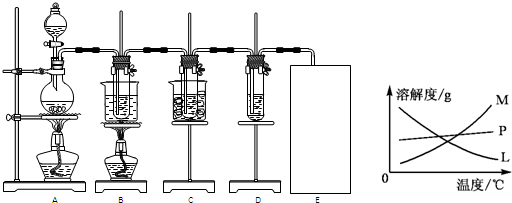
(Ⅱ)瑞典化学家舍勒将软锰矿(主要成分为MnO2)与浓盐酸混合加热,在世界上首先得到了氯气.已知Cl2和碱溶液在不同条件下,得到的产物不同,某兴趣小组用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质.( 3Cl2+6KOH
KClO3+5KCl+3H2O )图中:A为氯气发生装置;B的试管里盛有15mL 30% KOH溶液,并置于水浴中;C的试管里盛有15mL 8% NaOH溶液,并置于冰水浴中;D的试管里加有紫色石蕊试液.
请填写下列空白:
(1)制取氯气时,在圆底烧瓶里加入一定质量的二氧化锰,通过
(2)反应完毕经冷却后,B的试管中有大量晶体析出.图中符合该晶体溶解度曲线的是
(3)实验中可观察到D的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
(4)请在装置图方框中画出缺少的实验装置,并注明试剂.
查看习题详情和答案>>

(1)某小组同学欲用4mol/L的盐酸配制230mL 0.4mol/L 盐酸溶液,需取用4mol/L盐酸
25
25
mL,实验中需要用到的玻璃仪器有烧杯
烧杯
、250ml容量瓶
250ml容量瓶
、量筒、烧杯、胶头滴管.(2)下列实验操作使配制的溶液浓度偏低的是
BC
BC
A.容量瓶洗涤后未干燥
B.移液时,有少量溶液溅出
C.定容时,加水不慎超过刻度线,又倒出一些
D.定容时,俯视刻度线
E.装入试剂瓶时,有少量溶液溅出
(Ⅱ)瑞典化学家舍勒将软锰矿(主要成分为MnO2)与浓盐酸混合加热,在世界上首先得到了氯气.已知Cl2和碱溶液在不同条件下,得到的产物不同,某兴趣小组用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质.( 3Cl2+6KOH
| ||
请填写下列空白:
(1)制取氯气时,在圆底烧瓶里加入一定质量的二氧化锰,通过
分液漏斗
分液漏斗
(填仪器名称)向圆底烧瓶中加入适量的浓盐酸.装置A中反应的离子方程式MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
.
| ||
(2)反应完毕经冷却后,B的试管中有大量晶体析出.图中符合该晶体溶解度曲线的是
M
M
(填编号字母);从B的试管中分离出该晶体的方法是过滤
过滤
(填实验操作名称).该小组同学发现制得的氯酸钾产量偏低,可能的一种原因是Cl2中含有杂质,该杂质成分HCl
HCl
(除水蒸气外,填化学式),如何改进AB间增加一个盛有饱和氯化钠溶液吸收氯化氢的洗气装置
AB间增加一个盛有饱和氯化钠溶液吸收氯化氢的洗气装置
;(3)实验中可观察到D的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为 红 红 色 |
氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成的HClO将石蕊氧化为无色物质 氯气与水反应生成的HClO将石蕊氧化为无色物质 |
(Ⅰ)下表是元素周期表的一部分,针对表中的①~⑥种元素,填写下列空白:
(1)在这些元素中,单质的化学性质最不活泼的是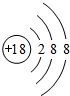
 .
.
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是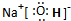
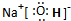 .
.
(3)最高价氧化物是两性氧化物的元素是
(4)①和④两元素分别形成的最高价氧化物中,熔点较高的是
(5)科学家借助元素周期表研究合成有特定性质的新物质,如在
(Ⅱ)化学与我们日常生活中的吃、穿、住、行、医关系密切,其中油脂、淀粉、蛋白质是我们食物中提供能量的主要物质.请按要求回答下列问题(填名称):
(1)油脂在酸性条件下水解的最终产物是
(2)淀粉水解的最终产物是
(3)蛋白质在一定条件下能发生水解反应,最终转化为
查看习题详情和答案>>
| 族周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ||||||||
| 2 | ① | |||||||
| 3 | ② | ③ | ④ | ⑤ | ⑥ |
Ar
Ar
(填具体元素符号).原子结构示意图为

(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是
HClO4
HClO4
,碱性最强的化合物的电子式是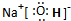
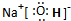
(3)最高价氧化物是两性氧化物的元素是
Al
Al
(填具体元素符号);写出它的氧化物与氢氧化钠反应的化学方程式Al2O3+2OH-=2AlO2-+H2O
Al2O3+2OH-=2AlO2-+H2O
.(4)①和④两元素分别形成的最高价氧化物中,熔点较高的是
SiO2
SiO2
(填具体化学式).(5)科学家借助元素周期表研究合成有特定性质的新物质,如在
金属与非金属交界处
金属与非金属交界处
寻找半导体材料.(Ⅱ)化学与我们日常生活中的吃、穿、住、行、医关系密切,其中油脂、淀粉、蛋白质是我们食物中提供能量的主要物质.请按要求回答下列问题(填名称):
(1)油脂在酸性条件下水解的最终产物是
高级脂肪酸
高级脂肪酸
和甘油
甘油
.(2)淀粉水解的最终产物是
葡萄糖
葡萄糖
.若要检验淀粉在淀粉酶作用下已经发生了水解,可取少量上述溶液加入新制氢氧化铜或银氨溶液
新制氢氧化铜或银氨溶液
,加热后再根据实验现象判断;若要检验淀粉没有完全水解,可取少量上述溶液加入几滴碘水
碘水
,应观察到出现蓝色.(3)蛋白质在一定条件下能发生水解反应,最终转化为
氨基酸
氨基酸
.
(Ⅰ)下表是元素周期表的一部分,针对表中的①~⑥种元素,填写下列空白:
(1)在这些元素中,单质的化学性质最不活泼的是______(填具体元素符号).原子结构示意图为______.
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是______,碱性最强的化合物的电子式是______.
(3)最高价氧化物是两性氧化物的元素是______ (填具体元素符号);写出它的氧化物与氢氧化钠反应的化学方程式______.
(4)①和④两元素分别形成的最高价氧化物中,熔点较高的是______(填具体化学式).
(5)科学家借助元素周期表研究合成有特定性质的新物质,如在______寻找半导体材料.
(Ⅱ)化学与我们日常生活中的吃、穿、住、行、医关系密切,其中油脂、淀粉、蛋白质是我们食物中提供能量的主要物质.请按要求回答下列问题(填名称):
(1)油脂在酸性条件下水解的最终产物是______和______.
(2)淀粉水解的最终产物是______.若要检验淀粉在淀粉酶作用下已经发生了水解,可取少量上述溶液加入______,加热后再根据实验现象判断;若要检验淀粉没有完全水解,可取少量上述溶液加入几滴______,应观察到出现蓝色.
(3)蛋白质在一定条件下能发生水解反应,最终转化为______.
查看习题详情和答案>>
| 族周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ||||||||
| 2 | ① | |||||||
| 3 | ② | ③ | ④ | ⑤ | ⑥ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是______,碱性最强的化合物的电子式是______.
(3)最高价氧化物是两性氧化物的元素是______ (填具体元素符号);写出它的氧化物与氢氧化钠反应的化学方程式______.
(4)①和④两元素分别形成的最高价氧化物中,熔点较高的是______(填具体化学式).
(5)科学家借助元素周期表研究合成有特定性质的新物质,如在______寻找半导体材料.
(Ⅱ)化学与我们日常生活中的吃、穿、住、行、医关系密切,其中油脂、淀粉、蛋白质是我们食物中提供能量的主要物质.请按要求回答下列问题(填名称):
(1)油脂在酸性条件下水解的最终产物是______和______.
(2)淀粉水解的最终产物是______.若要检验淀粉在淀粉酶作用下已经发生了水解,可取少量上述溶液加入______,加热后再根据实验现象判断;若要检验淀粉没有完全水解,可取少量上述溶液加入几滴______,应观察到出现蓝色.
(3)蛋白质在一定条件下能发生水解反应,最终转化为______.
查看习题详情和答案>>
(Ⅰ)下表是元素周期表的一部分,针对表中的①~⑥种元素,填写下列空白:
(1)在这些元素中,单质的化学性质最不活泼的是______(填具体元素符号).原子结构示意图为______.
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是______,碱性最强的化合物的电子式是______.
(3)最高价氧化物是两性氧化物的元素是______(填具体元素符号);写出它的氧化物与氢氧化钠反应的化学方程式______.
(4)①和④两元素分别形成的最高价氧化物中,熔点较高的是______(填具体化学式).
(5)科学家借助元素周期表研究合成有特定性质的新物质,如在______寻找半导体材料.
(Ⅱ)化学与我们日常生活中的吃、穿、住、行、医关系密切,其中油脂、淀粉、蛋白质是我们食物中提供能量的主要物质.请按要求回答下列问题(填名称):
(1)油脂在酸性条件下水解的最终产物是______和______.
(2)淀粉水解的最终产物是______.若要检验淀粉在淀粉酶作用下已经发生了水解,可取少量上述溶液加入______,加热后再根据实验现象判断;若要检验淀粉没有完全水解,可取少量上述溶液加入几滴______,应观察到出现蓝色.
(3)蛋白质在一定条件下能发生水解反应,最终转化为______.
查看习题详情和答案>>
| 族周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ||||||||
| 2 | ① | |||||||
| 3 | ② | ③ | ④ | ⑤ | ⑥ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是______,碱性最强的化合物的电子式是______.
(3)最高价氧化物是两性氧化物的元素是______(填具体元素符号);写出它的氧化物与氢氧化钠反应的化学方程式______.
(4)①和④两元素分别形成的最高价氧化物中,熔点较高的是______(填具体化学式).
(5)科学家借助元素周期表研究合成有特定性质的新物质,如在______寻找半导体材料.
(Ⅱ)化学与我们日常生活中的吃、穿、住、行、医关系密切,其中油脂、淀粉、蛋白质是我们食物中提供能量的主要物质.请按要求回答下列问题(填名称):
(1)油脂在酸性条件下水解的最终产物是______和______.
(2)淀粉水解的最终产物是______.若要检验淀粉在淀粉酶作用下已经发生了水解,可取少量上述溶液加入______,加热后再根据实验现象判断;若要检验淀粉没有完全水解,可取少量上述溶液加入几滴______,应观察到出现蓝色.
(3)蛋白质在一定条件下能发生水解反应,最终转化为______.
(2013?南开区一模)X、Y、Z、W、R是元素周期表前四周期中的常见元素,其相关信息如下表:
(1)W在元素周期表中的位置为
(2)X与氢两元素按原子数目比1:3和2:4构成分子A和B,A的结构式为
 ;B的电子式为
;B的电子式为
 .化合物ZY中存在的化学键类型为
.化合物ZY中存在的化学键类型为
(3)砷(As)是人体必需的微量元素,与X同一主族,As原子比X原子多两个电子层,则砷的原子序数为
(4)用RCl3溶液腐蚀铜线路板的离子方程式为
(5)Z-W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成.该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2═17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0mol/L HCl溶液中能完全释放出H2.1mol Zl7W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为
查看习题详情和答案>>
| 元素 | 相关信息 |
| X | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
| Y | 地壳中含量最高的元素 |
| Z | 存在质量数为23,中子数为11的核素 |
| W | 生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质 |
| R | 有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
第三周期第ⅢA族
第三周期第ⅢA族
;X、Y、Z、W四种元素的原子半径从大到小的顺序是Mg>Al>N>O
Mg>Al>N>O
(用元素符号表示).(2)X与氢两元素按原子数目比1:3和2:4构成分子A和B,A的结构式为




离子键
离子键
.(3)砷(As)是人体必需的微量元素,与X同一主族,As原子比X原子多两个电子层,则砷的原子序数为
33
33
,其最高价氧化物的化学式为As2O5
As2O5
.该族2~4周期元素的气态氢化物的稳定性从大到小的顺序是NH3>PH3>AsH3
NH3>PH3>AsH3
(用化学式表示).(4)用RCl3溶液腐蚀铜线路板的离子方程式为
2Fe3++Cu=Cu2++2Fe2+
2Fe3++Cu=Cu2++2Fe2+
.检验溶液中R3+常用的试剂是KSCN溶液
KSCN溶液
,可以观察到的现象是溶液呈红色
溶液呈红色
.(5)Z-W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成.该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2═17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0mol/L HCl溶液中能完全释放出H2.1mol Zl7W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为
52mol
52mol
.


