题目内容
(Ⅰ)下表是元素周期表的一部分,针对表中的①~⑥种元素,填写下列空白:
(1)在这些元素中,单质的化学性质最不活泼的是______(填具体元素符号).原子结构示意图为______.
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是______,碱性最强的化合物的电子式是______.
(3)最高价氧化物是两性氧化物的元素是______(填具体元素符号);写出它的氧化物与氢氧化钠反应的化学方程式______.
(4)①和④两元素分别形成的最高价氧化物中,熔点较高的是______(填具体化学式).
(5)科学家借助元素周期表研究合成有特定性质的新物质,如在______寻找半导体材料.
(Ⅱ)化学与我们日常生活中的吃、穿、住、行、医关系密切,其中油脂、淀粉、蛋白质是我们食物中提供能量的主要物质.请按要求回答下列问题(填名称):
(1)油脂在酸性条件下水解的最终产物是______和______.
(2)淀粉水解的最终产物是______.若要检验淀粉在淀粉酶作用下已经发生了水解,可取少量上述溶液加入______,加热后再根据实验现象判断;若要检验淀粉没有完全水解,可取少量上述溶液加入几滴______,应观察到出现蓝色.
(3)蛋白质在一定条件下能发生水解反应,最终转化为______.
| 族周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ||||||||
| 2 | ① | |||||||
| 3 | ② | ③ | ④ | ⑤ | ⑥ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是______,碱性最强的化合物的电子式是______.
(3)最高价氧化物是两性氧化物的元素是______(填具体元素符号);写出它的氧化物与氢氧化钠反应的化学方程式______.
(4)①和④两元素分别形成的最高价氧化物中,熔点较高的是______(填具体化学式).
(5)科学家借助元素周期表研究合成有特定性质的新物质,如在______寻找半导体材料.
(Ⅱ)化学与我们日常生活中的吃、穿、住、行、医关系密切,其中油脂、淀粉、蛋白质是我们食物中提供能量的主要物质.请按要求回答下列问题(填名称):
(1)油脂在酸性条件下水解的最终产物是______和______.
(2)淀粉水解的最终产物是______.若要检验淀粉在淀粉酶作用下已经发生了水解,可取少量上述溶液加入______,加热后再根据实验现象判断;若要检验淀粉没有完全水解,可取少量上述溶液加入几滴______,应观察到出现蓝色.
(3)蛋白质在一定条件下能发生水解反应,最终转化为______.
(Ⅰ)由元素在周期表中的位置可知,①为C,②为Na,③为Al,④为Si,⑤为Cl,⑥为Ar,
(1)稀有气体原子最外层为稳定结构,Ar化学性质最稳定;Ar原子核外有3个电子层,由里到外各层电子数为2、8、8,结构示意图为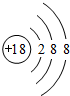 ,
,
故答案为:Ar; ;
;
(2)HClO4是最强的酸;氢氧化钠的碱性最强,由钠离子与氢氧根离子构成,电子式为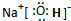 ,
,
故答案为:HClO4;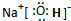 ;
;
(3)氧化铝是两性氧化物;氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应离子方程式为:Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al;Al2O3+2OH-=2AlO2-+H2O;
(4)二氧化硅水原子晶体,二氧化碳属于分子晶体,SiO2的熔点更高,
故答案为:SiO2;
(5)处于金属与非金属交界处的元素既表现金属性又表现非金属性,可以在此寻找半导体材料,
故答案为:金属与非金属交界处;
(Ⅱ)(1)油脂在酸性条件下最终水解为高级脂肪酸钠与甘油;
故答案为:高级脂肪酸、甘油;
(2)淀粉水解的最终产物是葡萄糖;碱性条件下,加入新制氢氧化铜或银氨溶液,有砖红色沉淀生成或有银镜现象产生,说明淀粉已经水解;溶液中滴入碘水,若若不变蓝,说明淀粉完全水解,
故答案为:葡萄糖;新制氢氧化铜或银氨溶液;碘水;
(3)蛋白质在一定条件下能发生水解反应,最终转化为氨基酸.
故答案为:氨基酸.
(1)稀有气体原子最外层为稳定结构,Ar化学性质最稳定;Ar原子核外有3个电子层,由里到外各层电子数为2、8、8,结构示意图为
 ,
,故答案为:Ar;
 ;
;(2)HClO4是最强的酸;氢氧化钠的碱性最强,由钠离子与氢氧根离子构成,电子式为
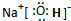 ,
,故答案为:HClO4;
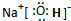 ;
;(3)氧化铝是两性氧化物;氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应离子方程式为:Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al;Al2O3+2OH-=2AlO2-+H2O;
(4)二氧化硅水原子晶体,二氧化碳属于分子晶体,SiO2的熔点更高,
故答案为:SiO2;
(5)处于金属与非金属交界处的元素既表现金属性又表现非金属性,可以在此寻找半导体材料,
故答案为:金属与非金属交界处;
(Ⅱ)(1)油脂在酸性条件下最终水解为高级脂肪酸钠与甘油;
故答案为:高级脂肪酸、甘油;
(2)淀粉水解的最终产物是葡萄糖;碱性条件下,加入新制氢氧化铜或银氨溶液,有砖红色沉淀生成或有银镜现象产生,说明淀粉已经水解;溶液中滴入碘水,若若不变蓝,说明淀粉完全水解,
故答案为:葡萄糖;新制氢氧化铜或银氨溶液;碘水;
(3)蛋白质在一定条件下能发生水解反应,最终转化为氨基酸.
故答案为:氨基酸.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目