网址:http://m.1010jiajiao.com/timu_id_4431005[举报]

请回答下列问题:
(1)写出A装置中玻璃仪器的名称:酒精灯、____________、____________。
(2)实验开始后,写出B中反应的离子方程式_____________________________________。
(3)C中的现象是________________________,E装置的作用是______________________。
(4)按下图所示称取一定量的Na2SO3样品放入A装置的烧瓶中,滴入足量的H2SO4完全反应。然后将B中完全反应后的溶液与足量的BaCl2溶液反应,过滤、洗涤、干燥,得白色沉淀

(5)在过滤沉淀时若过滤液出现浑浊,则必须要重复___________操作,若该学生没有重复该操作则测定的结果将___________(填“偏高”“偏低”或“无影响”)。
(6)要使测定结果准确,第一,装置气密性必须良好;第二,应先点燃___________处酒精灯(填装置字母)。
(二)下列有关化学实验的基本操作及安全知识的叙述,不正确的是_________(填序号)。
A.用托盘天平称取
B.附着于试管内壁的苯酚,可用碱液洗涤
C.用碱式滴定管量取20.00 mL 0.100 0 mol·L-1的高锰酸钾溶液
D.用渗析法分离淀粉中混有的NaNO3杂质
E.配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌
F.切割白磷时,必须用镊子夹取,置于桌面上的玻璃片上,小心用刀切割
G.实验时,不慎打翻燃着的酒精灯,可立即用湿抹布盖灭火焰
H.用重结晶法可以除去硝酸钾中混有的少量氯化钠
I.在中学《硫酸铜晶体里结晶水含量测定》的实验中,称量操作至少需要四次
J.配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分
查看习题详情和答案>>
(1)写出A装置中玻璃仪器的名称:酒精灯、___。
(2)实验开始后,写出B中反应的离子方程式____。
(3)C中的现象是___,E装置的作用是____。
(4)按下图所示称取一定量的Na2SO3样品放入A装置的烧瓶中,滴入足量的H2SO4完全反应然后将B中完全反应后的溶液与足量的BaCl2溶液反应,过滤、洗涤、干燥,得白色沉淀23.3 g,则原样品中Na2SO3的纯度为____(精确到 0.1%)。

(6)要使测定结果准确,第一,装置气密性必须良好;第二,应先点燃___ 处酒精灯(填装置字母)。
(Ⅱ)(7)下列有关化学实验的基本操作及安全知识的叙述,不正确的是____ (填序号)。
A.用托盘天平称取10. 55 g干燥的NaCl固体
B.附着于试管内壁的苯酚,可用碱液洗涤
C.用碱式滴定管量取20. 00 mL 0.100 0 mol·L-1的高锰酸钾溶液
D.用渗析法分离淀粉中混有的NaNO3杂质
E.配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不 断搅拌
F.切割白磷时,必须用镊子夹取,置于桌面上的玻璃片上,小心用刀切割
G.实验时,不慎打翻燃着的酒精灯,可立即用湿抹布盖灭火焰
H.用重结晶法可以除去硝酸钾中混有的少量氯化钠
I.在中学《硫酸铜晶体里结晶水含量测定》的实验中,称量操作至少需要四次
J.配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:(1)一定温度下,在一个固定容积的密闭容器中,可逆反应 A(g)+2B(g)=4C (g)△H>0 达到平衡时,c(A)=2mol?L-1,c(B)=7mol?L-1,c(C)=4mol?L-1.试确定B的起始浓度c(B)的取值范围是
A.增加C的物质的量 B.加压 C.升温 D.使用催化剂
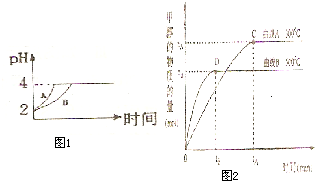
(2)常温下,取 pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图1所示.则图中表示醋酸溶液中pH变化曲线的是
(3)在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO(g)+2H2(g)→CH3OH(g).反应达到平衡时,平衡常数表达式K=
| c(CH3OH) |
| c(CO)×c2(H2) |
| c(CH3OH) |
| c(CO)×c2(H2) |
| 2nB |
| 3tB |
| 2nB |
| 3tB |
(4)难溶电解质在水溶液中存在着电离平衡.在常温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数.例如:
Cu(OH)2(s)=Cu2+(aq)+2OH-(aq),Ksp=c(Cu2+)[c(OH-)]2=2×10-20
当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解.若某CuSO4溶液里c( Cu2+)=0.02mol?L-1,如果生成Cu(OH)2沉淀,应调整溶液pH,使之大于
(5)常温下,某纯碱(Na2CO3) 溶液中滴入酚酞,溶液呈红色.则该溶液呈
已知:甲苯与溴在有水存在时能反应.

| 物质 | 甲苯 | 1-丙醇 | 1-溴丙烷 | |
| 沸点℃ | 110.8 | 97.2 | 71 | |
| 物质 | 对溴甲苯 | 邻溴甲苯 | ||
| 沸点℃ | 184.3 | 181.7 | ||
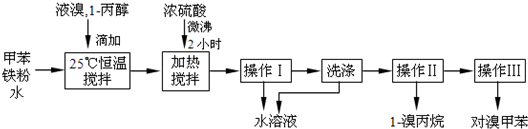
(1)液溴的颜色是
(2)25℃恒温搅拌至溴的颜色完全褪去时完成甲苯的溴代反应.搅拌的目的是
(3)加热搅拌操作中加入浓硫酸,搅拌,完成1-丙醇的取代反应,加入浓硫酸的作用是
(4)操作Ⅰ的名称是
(5)经以上分离操作后,粗对溴甲苯中还含有的最主要杂质为
(6)分离出的水溶液中含HBr、H2SO4和Fe3+离子,将水溶液稀释定容至1000mL,取20.00mL,加入几滴甲基橙作指示剂,用一定浓度的NaOH溶液滴定,测定出HBr的物质的量明显低于理论值,原因是