题目内容
 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:(1)一定温度下,在一个固定容积的密闭容器中,可逆反应 A(g)+2B(g)=4C (g)△H>0 达到平衡时,c(A)=2mol?L-1,c(B)=7mol?L-1,c(C)=4mol?L-1.试确定B的起始浓度c(B)的取值范围是
3mol/L≤c(B)≤9mol/L
3mol/L≤c(B)≤9mol/L
;若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是C
C
.A.增加C的物质的量 B.加压 C.升温 D.使用催化剂
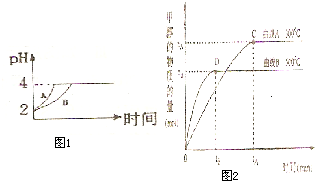
(2)常温下,取 pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图1所示.则图中表示醋酸溶液中pH变化曲线的是
B
B
( 填“A”或“B”). 设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为 m2. 则 m1<
<
m2 ( 选填“<”、“=”、“>”)(3)在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO(g)+2H2(g)→CH3OH(g).反应达到平衡时,平衡常数表达式K=
| c(CH3OH) |
| c(CO)×c2(H2) |
| c(CH3OH) |
| c(CO)×c2(H2) |
减小
减小
(填“增大”、“减小”或“不变”).在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=| 2nB |
| 3tB |
| 2nB |
| 3tB |
(4)难溶电解质在水溶液中存在着电离平衡.在常温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数.例如:
Cu(OH)2(s)=Cu2+(aq)+2OH-(aq),Ksp=c(Cu2+)[c(OH-)]2=2×10-20
当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解.若某CuSO4溶液里c( Cu2+)=0.02mol?L-1,如果生成Cu(OH)2沉淀,应调整溶液pH,使之大于
5
5
; 要使0.2mol?L-1的CuSO4 溶液中Cu2+沉淀较为完全 (使Cu2+浓度降至原来的千分之一)则应向溶液里加NaOH溶液,使溶液pH值为6
6
.(5)常温下,某纯碱(Na2CO3) 溶液中滴入酚酞,溶液呈红色.则该溶液呈
碱性
碱性
性.在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na2CO3电离出的CO32-水解所致.请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)向红色溶液中加入足量BaCl2溶液,如果溶液还显红色说明甲正确,红色褪去说明乙正确
向红色溶液中加入足量BaCl2溶液,如果溶液还显红色说明甲正确,红色褪去说明乙正确
.分析:(1)由正反应开始建立平衡,B的起始浓度最大,由逆反应开始建立平衡,B的起始浓度最小,据此计算;
结合选项运用平衡移动原理分析解答;
(2)从醋酸是弱电解质的角度分析,醋酸与Zn反应同时,电离出H+,pH变化较缓慢;
pH值变化相同,醋酸参加反应的氢离子比盐酸多;
(3)化学平衡常数等于生成物的浓度系数次幂之积除以反应物的浓度系数次幂之积;
根据图象可知,温度越高,甲醇的含量越低,平衡向逆反应移动,升高温度平衡向吸热方向移动,说明该反应正反应为放热反应;
先根据图象依据v=
求出求出v(CH3OH),然后根据速率之比等于化学计量数之比求出v(H2);
(4)根据c(OH-)=
计算氢氧根离子浓度,从而确定溶液的pH;
(5)常温下,纯碱(Na2CO3) 溶液中滴入酚酞,溶液呈红色,则该溶液呈碱性;
向红色溶液中加入足量BaCl2溶液,生成碳酸钡沉淀,根据颜色的变化分析.
结合选项运用平衡移动原理分析解答;
(2)从醋酸是弱电解质的角度分析,醋酸与Zn反应同时,电离出H+,pH变化较缓慢;
pH值变化相同,醋酸参加反应的氢离子比盐酸多;
(3)化学平衡常数等于生成物的浓度系数次幂之积除以反应物的浓度系数次幂之积;
根据图象可知,温度越高,甲醇的含量越低,平衡向逆反应移动,升高温度平衡向吸热方向移动,说明该反应正反应为放热反应;
先根据图象依据v=
| ||
| △t |
(4)根据c(OH-)=
|
(5)常温下,纯碱(Na2CO3) 溶液中滴入酚酞,溶液呈红色,则该溶液呈碱性;
向红色溶液中加入足量BaCl2溶液,生成碳酸钡沉淀,根据颜色的变化分析.
解答:解:(1)由正反应开始建立平衡,B的起始浓度最大,B的浓度变化量为4mol/L×
=2mol/L,故B浓度最大值为7mol/L+2mol/L=9mol/L,
由逆反应开始建立平衡,B的起始浓度最小,B的浓度变化=2△c(A)=2mol/L×2=4mol/L,故B的浓度最小值为7mol/L-4mol/L=3mol/L,故B的起始浓度c(B)的取值范围是3 mol/L≤c(B)≤9 mol/L;
若改变条件重新达到平衡后体系中C的质量分数增大,应使平衡向正反应方向移动,
A.增加C的物质的量,等效为增大压强,平衡向逆反应方向移动,C的质量分数降低,故A错误;
B.加压,平衡向逆反应方向移动,C的质量分数降低,故B错误;
C.升温,平衡向正反应方向移动,C的质量分数增大,故C正确;
D.使用催化剂,平衡不移动,C的质量分数不变,故D错误;
故答案为:3 mol/L≤c(B)≤9 mol/L;C;
(2)由于醋酸是弱电解质,与Zn反应同时,电离出H+,所以pH变化较缓慢,所以B曲线是醋酸溶液的pH变化曲线.由图知盐酸和醋酸的pH变化都是由2到4,盐酸中氢离子浓度逐渐减小,但醋酸中存在电离平衡,氢离子和锌反应时促进醋酸电离,补充反应的氢离子,所以醋酸是边反应边电离H+,故消耗的Zn多,所以m1<m2.
故答案为:B;<;
(3)因化学平衡常数等于生成物的浓度系数次幂之积除以反应物的浓度系数次幂之积,故CO(g)+2H2(g)?CH3OH(g)的平衡常数K=
;
由图可知,升高温度,甲醇的含量降低,平衡逆向移动,则化学平衡常数减小;
由图象可知,在500℃时,2min到达平衡,甲醇的平均反应速率v(CH3OH)=
mol?(L?min)-1 =
mol?(L?min)-1 ,由速率之比等于化学计量数之比求出,则v(H2)=2v(CH3OH)=
mol?(L?min)-1;
故答案为:
;减小;
mol?(L?min)-1;
(4)c(OH-)=
mol/L=10-9 mol/L,则c(H+)=10-5 mol/L,所以溶液的pH=-lg10-5=5;
使0.2mol?L-1的CuSO4 溶液中Cu2+沉淀较为完全,Cu2+浓度降至为2×10-4 mol/L,故c(OH-)=
mol/L=10-8 mol/L,则c(H+)=10-6 mol/L,所以溶液的pH=-lg10-6=6,
故答案为:5;6;
(5)常温下,纯碱(Na2CO3) 溶液中滴入酚酞,溶液呈红色,则该溶液呈碱性;
要验证该溶液遇酚酞呈红色原因,可用以下方法:
方法一:向红色溶液中加入足量BaCl2溶液,如果溶液显红色,说明甲正确,如果红色褪去,说明乙正确;
方法二:加热,如果红色不变说明甲正确,如果红色加深,说明乙正确,
故答案为:向红色溶液中加入足量BaCl2溶液,如果溶液还显红色说明甲正确,红色褪去说明乙正确.
| 1 |
| 2 |
由逆反应开始建立平衡,B的起始浓度最小,B的浓度变化=2△c(A)=2mol/L×2=4mol/L,故B的浓度最小值为7mol/L-4mol/L=3mol/L,故B的起始浓度c(B)的取值范围是3 mol/L≤c(B)≤9 mol/L;
若改变条件重新达到平衡后体系中C的质量分数增大,应使平衡向正反应方向移动,
A.增加C的物质的量,等效为增大压强,平衡向逆反应方向移动,C的质量分数降低,故A错误;
B.加压,平衡向逆反应方向移动,C的质量分数降低,故B错误;
C.升温,平衡向正反应方向移动,C的质量分数增大,故C正确;
D.使用催化剂,平衡不移动,C的质量分数不变,故D错误;
故答案为:3 mol/L≤c(B)≤9 mol/L;C;
(2)由于醋酸是弱电解质,与Zn反应同时,电离出H+,所以pH变化较缓慢,所以B曲线是醋酸溶液的pH变化曲线.由图知盐酸和醋酸的pH变化都是由2到4,盐酸中氢离子浓度逐渐减小,但醋酸中存在电离平衡,氢离子和锌反应时促进醋酸电离,补充反应的氢离子,所以醋酸是边反应边电离H+,故消耗的Zn多,所以m1<m2.
故答案为:B;<;
(3)因化学平衡常数等于生成物的浓度系数次幂之积除以反应物的浓度系数次幂之积,故CO(g)+2H2(g)?CH3OH(g)的平衡常数K=
| c(CH3OH) |
| c(CO)×c2(H2) |
由图可知,升高温度,甲醇的含量降低,平衡逆向移动,则化学平衡常数减小;
由图象可知,在500℃时,2min到达平衡,甲醇的平均反应速率v(CH3OH)=
| ||
| tBmin |
| nB |
| 3tB |
| 2nB |
| 3tB |
故答案为:
| c(CH3OH) |
| c(CO)×c2(H2) |
| 2nB |
| 3tB |
(4)c(OH-)=
|
使0.2mol?L-1的CuSO4 溶液中Cu2+沉淀较为完全,Cu2+浓度降至为2×10-4 mol/L,故c(OH-)=
|
故答案为:5;6;
(5)常温下,纯碱(Na2CO3) 溶液中滴入酚酞,溶液呈红色,则该溶液呈碱性;
要验证该溶液遇酚酞呈红色原因,可用以下方法:
方法一:向红色溶液中加入足量BaCl2溶液,如果溶液显红色,说明甲正确,如果红色褪去,说明乙正确;
方法二:加热,如果红色不变说明甲正确,如果红色加深,说明乙正确,
故答案为:向红色溶液中加入足量BaCl2溶液,如果溶液还显红色说明甲正确,红色褪去说明乙正确.
点评:本题考查较为综合,涉及弱电解质的电离、化学平衡、难溶电解质的溶解平衡、盐类水解等知识点,难度较大,弱电解质的电离平衡、化学平衡是高考的热点,应熟练掌握.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
 化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种.且均符合勒夏特列原理.请回答下列问题.
化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种.且均符合勒夏特列原理.请回答下列问题. 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题: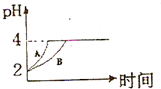 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:常温下,取 pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:常温下,取 pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是