题目内容
(I)某学生为了测定部分变质的Na2SO3样品的纯度,设计了如下实验:
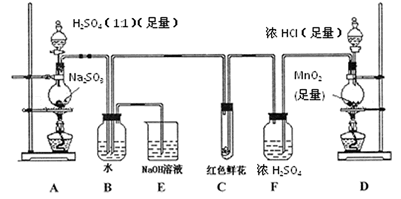
请回答下列问题:
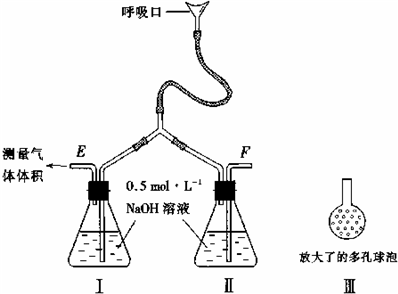
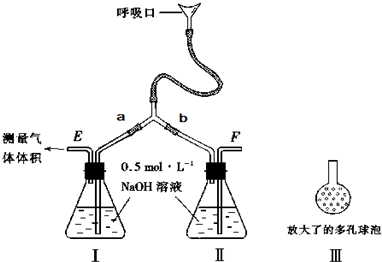
(1)写出A装置中玻璃仪器的名称:酒精灯、___。
(2)实验开始后,写出B中反应的离子方程式____。
(3)C中的现象是___,E装置的作用是____。
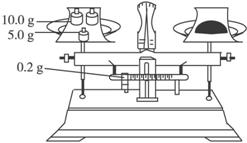
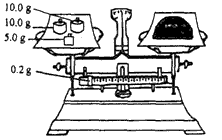
(4)按下图所示称取一定量的Na2SO3样品放入A装置的烧瓶中,滴入足量的H2SO4完全反应然后将B中完全反应后的溶液与足量的BaCl2溶液反应,过滤、洗涤、干燥,得白色沉淀23.3 g,则原样品中Na2SO3的纯度为____(精确到 0.1%)。
(1)写出A装置中玻璃仪器的名称:酒精灯、___。
(2)实验开始后,写出B中反应的离子方程式____。
(3)C中的现象是___,E装置的作用是____。
(4)按下图所示称取一定量的Na2SO3样品放入A装置的烧瓶中,滴入足量的H2SO4完全反应然后将B中完全反应后的溶液与足量的BaCl2溶液反应,过滤、洗涤、干燥,得白色沉淀23.3 g,则原样品中Na2SO3的纯度为____(精确到 0.1%)。
(5)在过滤沉淀时若过滤液出现浑浊,则必须要重复____操作,若该学生没有重复该操作则测定的结果将____(填“偏高”“偏低”或“无影响”)。
(6)要使测定结果准确,第一,装置气密性必须良好;第二,应先点燃___ 处酒精灯(填装置字母)。
(Ⅱ)(7)下列有关化学实验的基本操作及安全知识的叙述,不正确的是____ (填序号)。
A.用托盘天平称取10. 55 g干燥的NaCl固体
B.附着于试管内壁的苯酚,可用碱液洗涤
C.用碱式滴定管量取20. 00 mL 0.100 0 mol·L-1的高锰酸钾溶液
D.用渗析法分离淀粉中混有的NaNO3杂质
E.配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不 断搅拌
F.切割白磷时,必须用镊子夹取,置于桌面上的玻璃片上,小心用刀切割
G.实验时,不慎打翻燃着的酒精灯,可立即用湿抹布盖灭火焰
H.用重结晶法可以除去硝酸钾中混有的少量氯化钠
I.在中学《硫酸铜晶体里结晶水含量测定》的实验中,称量操作至少需要四次
J.配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
(6)要使测定结果准确,第一,装置气密性必须良好;第二,应先点燃___ 处酒精灯(填装置字母)。
(Ⅱ)(7)下列有关化学实验的基本操作及安全知识的叙述,不正确的是____ (填序号)。
A.用托盘天平称取10. 55 g干燥的NaCl固体
B.附着于试管内壁的苯酚,可用碱液洗涤
C.用碱式滴定管量取20. 00 mL 0.100 0 mol·L-1的高锰酸钾溶液
D.用渗析法分离淀粉中混有的NaNO3杂质
E.配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不 断搅拌
F.切割白磷时,必须用镊子夹取,置于桌面上的玻璃片上,小心用刀切割
G.实验时,不慎打翻燃着的酒精灯,可立即用湿抹布盖灭火焰
H.用重结晶法可以除去硝酸钾中混有的少量氯化钠
I.在中学《硫酸铜晶体里结晶水含量测定》的实验中,称量操作至少需要四次
J.配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
(I)(1)圆底烧瓶 ,分液漏斗
(2)Cl2+SO2+2H2O=4H++2Cl-+SO42-
(3)红色鲜花褪色 ;吸收未反应的有毒气体,防止 有毒气体对大气的污染
(4)50.8%
(5)过滤 ;偏低
(6)D
(Ⅱ)(7)A、C、F、J
(2)Cl2+SO2+2H2O=4H++2Cl-+SO42-
(3)红色鲜花褪色 ;吸收未反应的有毒气体,防止 有毒气体对大气的污染
(4)50.8%
(5)过滤 ;偏低
(6)D
(Ⅱ)(7)A、C、F、J

练习册系列答案
相关题目