网址:http://m.1010jiajiao.com/timu_id_412327[举报]

著名的蓝瓶子实验操作步骤如下:
①如上图所示,在250mL锥形瓶中,依次加入2g NaOH、100mL H2O,3g C6H12O6(葡萄糖),搅拌溶解后,再加入3滴~5滴0.2%的亚甲基蓝溶液,振荡,混合液呈现蓝色.
②塞紧橡皮塞,将溶液静置,溶液变为无色.
③再打开瓶塞,振荡,溶液又变为蓝色.
④再塞紧橡皮塞,将溶液静置,溶液又变为无色.以上③、④可重复多次.
试回答下列问题:
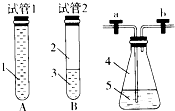
(1)某学生将起初配得的蓝色溶液分装在A、B两支试管中(如上图,A试管充满溶液,B中有少量溶液),塞上橡皮塞静置片刻,两溶液均显无色.若再同时振荡A、B试管,能显蓝色的是
(2)若塞紧锥形瓶塞并打开活塞a、b,通入足量氢气后,再关闭活塞a、b并振荡,溶液能否由无色变为蓝色?
(3)该实验中,影响溶液颜色互变快慢的主要因素有
(4)上述转化过程中,葡萄糖的作用是
(5)上述实验中葡萄糖也可用鲜橙汁代替,因为其中含有丰富的维生素C,且维生素C具有
(6)该实验中③、④操作能否无限次重复进行?
 亚甲基蓝(Methylnene Blue)在碱性条件下与葡萄糖作用生成亚甲基白(Methylene White).亚甲基蓝的结构简式:
亚甲基蓝(Methylnene Blue)在碱性条件下与葡萄糖作用生成亚甲基白(Methylene White).亚甲基蓝的结构简式: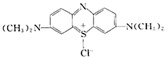
著名的蓝瓶子实验操作步骤如下:
①如图示在250mL锥形瓶中,依次加入2g NaOH、100mL H2O和3g葡萄糖,搅拌溶解后,再加入3滴~5滴0.2%的亚甲基蓝溶液,振荡混合液呈现蓝色;
②塞紧橡皮塞(活塞a、b关闭),将溶液静置,溶液变为无色;
③再打开瓶塞,振荡,溶液又变为蓝色;
④再塞紧橡皮塞,将溶液静置,溶液又变为无色.以上③、④可重复多次.
试回答下列问题:
(1)某学生将起初配得的蓝色溶液分装在A、B两支试管中(如上图,A试管充满溶液,B中有少量溶液),塞上橡皮塞静置片刻,两溶液均显无色.若再同时振荡A、B试管,能显蓝色的是
(2)若塞紧锥形瓶塞并打开活塞a、b,通入足量氢气后,再关闭活塞a、b并振荡,溶液能否由无色变为蓝色
(3)上述转化过程中,葡萄糖的作用是
(4)上述实验中葡萄糖也可用鲜橙汁(其中含丰富维生素C)代替,这是因为维生素C具有
(5)该实验中③、④操作能否无限次重复进行
⑴.玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流。下列有关实验过程中,肯定不需要使用玻璃棒进行操作的是 ▲ 。(可以多选)
A.用pH试纸测定Na2CO3溶液的pH
B.从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl
C.实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
D.配制一定物质的量浓度的氯化钠溶液
E.取某溶液做焰色反应实验,说明该溶液中含有钠元素。
F.用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验。
G.促使过饱和的硝酸钾溶液析出晶体
H.用倾析法进行分离、洗涤颗粒较大的沉淀。
⑵.下列实验能达到实验目的且符合安全要求的是 ▲ 。(可以多选)
⑶. 化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol·L-1的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如右图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体中滴加一滴浓盐酸,再立即将表面皿盖好。已知:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol·L-1的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如右图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体中滴加一滴浓盐酸,再立即将表面皿盖好。已知:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
①.e处发生反应的离子方程式为 ▲ ,该反应中发生反应的氧化剂和还原剂的物质的量
之比为 ▲ 。
②.b处的实验现象为 ▲ ,d处的实验现象为 ▲ 。
③.c处反应的化学方程式为 ▲ ,标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,
转移电子的物质的量为 ▲ mol。
④.通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱? ▲ (填“能”或
“不能”),若能,其氧化性由强到弱的顺序是 ▲ 。
查看习题详情和答案>>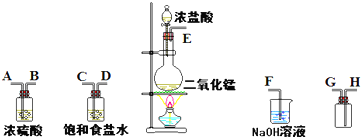
(1)连接上述仪器的正确顺序(填各接口处的字母):
(2)装置中,饱和食盐水的作用是
(3)化学实验中常用湿润的淀粉-KI试纸检验是否有Cl2产生.如果有Cl2产生,可观察到
(4)写出下列化学反应的方程式:
①气体发生装置中进行的反应:
| ||
| ||
②NaOH溶液中发生的反应:
(5)KMnO4的氧化性比MnO2强得多,实验室也可以用KMnO4固体和浓盐酸反应制取氯气,反应方程式如下:
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O.
①标出该反应电子转移的方向和数目
②氧化剂和还原剂的物质的量之比为
③当有0.2mole-转移时被氧化的HCl的质量是
④如果将20ml 12mol?L-1的浓盐酸与足量KMnO4充分反应,实际能收集到的氯气在标准状况下的体积将
A.≥1.68L B.>1.68L C.≤1.68L D.<1.68L.
A.滴定用的锥形瓶和滴定管都要用所盛溶液润洗
B.在粗盐的提纯实验中,溶解、过滤、蒸发都用到了玻璃棒
C.配制一定浓度的溶液时,俯视容量瓶的刻度线,会使配制的浓度偏高
D.配制FeCl3溶液时,将FeCl3固体溶于较浓盐酸中,然后再用水稀释到所需的浓度E.在铁粉存在下用溴水和苯反应制取溴苯时,无需加热
F.取1mL 20%蔗糖溶液,加入适量稀硫酸,水浴加热约5min后,再加入少量新制的Cu(OH)2,悬浊液加热,可检验蔗糖是否发生了水解
G.物质溶于水的过程中,一般有放热或吸热现象,若热效应不明显,溶解的操作可以在量筒中进行
Ⅱ在中学化学实验中,通常用无水硫酸铜来检验少量水的存在,然而,无水硫酸铜的吸湿性很强,需要时须现制现用.
方法Ⅰ:取2药匙细小的硫酸铜晶体置于
方法Ⅱ:取2药匙研碎的硫酸铜晶体于小烧杯中,加入20mL浓硫酸(质量分数不低于98%),并用玻璃棒搅拌,静置5min后倾去浓硫酸,用无水乙醇洗涤数次,倒在滤纸上晾干.
【交流与讨论】
(1)方法Ⅰ中,加热温度稍高时会出现变黑现象,原因是
| ||
| ||
| ||
| ||
(2)方法Ⅱ中,浓硫酸的作用是
(3)用制得的无水硫酸铜检验某双氧水中是否含水时,除了发现固体变蓝外,还发现该双氧水中有气泡产生,对此你有何猜想