题目内容
在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:
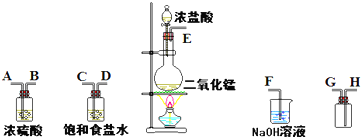
(1)连接上述仪器的正确顺序(填各接口处的字母):
(2)装置中,饱和食盐水的作用是
(3)化学实验中常用湿润的淀粉-KI试纸检验是否有Cl2产生.如果有Cl2产生,可观察到
(4)写出下列化学反应的方程式:
①气体发生装置中进行的反应:
②NaOH溶液中发生的反应:
(5)KMnO4的氧化性比MnO2强得多,实验室也可以用KMnO4固体和浓盐酸反应制取氯气,反应方程式如下:
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O.
①标出该反应电子转移的方向和数目
②氧化剂和还原剂的物质的量之比为
③当有0.2mole-转移时被氧化的HCl的质量是
④如果将20ml 12mol?L-1的浓盐酸与足量KMnO4充分反应,实际能收集到的氯气在标准状况下的体积将
A.≥1.68L B.>1.68L C.≤1.68L D.<1.68L.

(1)连接上述仪器的正确顺序(填各接口处的字母):
E
E
接C
C
;D
D
接A
A
;B
B
接H
H
;G
G
接F
F
.(2)装置中,饱和食盐水的作用是
除去氯气中的HCl杂质
除去氯气中的HCl杂质
;NaOH溶液的作用是吸收过量的氯气
吸收过量的氯气
.(3)化学实验中常用湿润的淀粉-KI试纸检验是否有Cl2产生.如果有Cl2产生,可观察到
试纸变蓝
试纸变蓝
,反应方程式2KI+Cl2═2KCl+I2
2KI+Cl2═2KCl+I2
.(4)写出下列化学反应的方程式:
①气体发生装置中进行的反应:
MnO2+4HCl(浓)
MnCl2+Cl2+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2+2H2O
| ||
②NaOH溶液中发生的反应:
2NaOH+Cl2═NaCl+NaClO+H2O
2NaOH+Cl2═NaCl+NaClO+H2O
(5)KMnO4的氧化性比MnO2强得多,实验室也可以用KMnO4固体和浓盐酸反应制取氯气,反应方程式如下:
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O.
①标出该反应电子转移的方向和数目
②氧化剂和还原剂的物质的量之比为
1:5
1:5
;③当有0.2mole-转移时被氧化的HCl的质量是
7.3g
7.3g
;该反应中被氧化和未被氧化的盐酸的物质的量之比是5:3
5:3
,④如果将20ml 12mol?L-1的浓盐酸与足量KMnO4充分反应,实际能收集到的氯气在标准状况下的体积将
D
D
.A.≥1.68L B.>1.68L C.≤1.68L D.<1.68L.
分析:(1)在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气,需要发生装置生成氯气,用饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,导气管长进短处收集氯气,最后用氢氧化钠溶液吸收多余的氯气;
(2)饱和食盐水是用来除去氯气中的氯化氢气体,降低氯气的溶解度;氯气有毒用氢氧化钠溶液吸收;
(3)氯气具有氧化性遇到淀粉碘化钾溶液会氧化碘离子为单质碘遇淀粉变蓝;
(4)①气体发生装置是二氧化锰和浓盐酸加热反应生成氯气的反应;
②氯气有毒用氢氧化钠溶液吸收,氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水;
(5)①依据元素化合价变化升降数值,结合氧化还原反应的双线桥标出电子转移方向和数目;
②依据氧化还原反应中元素化合价变化判断氧化剂和还原剂,计算氧化剂和还原剂的物质的量之比;
③依据化学方程式分析元素化合价变化,转移10mol电子氧化HCl10mol分析计算;16molHCl中氯元素化合价变化的做还原剂被氧化,化合价不变的氯化氢做酸未被氧化;
④浓盐酸易挥发出氯化氢混在氯气中,装置中的氯气不能被全部赶出,导致收集气体减少;
(2)饱和食盐水是用来除去氯气中的氯化氢气体,降低氯气的溶解度;氯气有毒用氢氧化钠溶液吸收;
(3)氯气具有氧化性遇到淀粉碘化钾溶液会氧化碘离子为单质碘遇淀粉变蓝;
(4)①气体发生装置是二氧化锰和浓盐酸加热反应生成氯气的反应;
②氯气有毒用氢氧化钠溶液吸收,氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水;
(5)①依据元素化合价变化升降数值,结合氧化还原反应的双线桥标出电子转移方向和数目;
②依据氧化还原反应中元素化合价变化判断氧化剂和还原剂,计算氧化剂和还原剂的物质的量之比;
③依据化学方程式分析元素化合价变化,转移10mol电子氧化HCl10mol分析计算;16molHCl中氯元素化合价变化的做还原剂被氧化,化合价不变的氯化氢做酸未被氧化;
④浓盐酸易挥发出氯化氢混在氯气中,装置中的氯气不能被全部赶出,导致收集气体减少;
解答:(1)在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气,需要发生装置生成氯气,用饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,导气管长进短处收集氯气,最后用氢氧化钠溶液吸收多余的氯气,装置连接顺序是E-C,D-A,B-H,G-F;
故答案为:ECDABHGF;
(2)饱和食盐水是用来除去氯气中的氯化氢气体,降低氯气的溶解度;氯气有毒用氢氧化钠溶液吸收,氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水;
故答案为:除去挥发出的氯化氢气体,抑制氯气在水中的溶解度;吸收过量的氯气;
(3)氯气具有氧化性遇到淀粉碘化钾溶液会氧化碘离子为单质碘遇淀粉变蓝,反应的化学方程式为:2KI+Cl2=2KCl+I2;
故答案为:试纸变蓝,2KI+Cl2=2KCl+I2 ;
(4)①气体发生装置是二氧化锰和浓盐酸加热反应生成氯气的反应,反应的化学方程式为:MnO2+4HCl
MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl
MnCl2+Cl2↑+2H2O;
②氯气有毒用氢氧化钠溶液吸收,氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O;
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(5)①依据元素化合价变化升降数值,结合氧化还原反应的双线桥标出电子转移方向和数目;锰元素化合价从+7价降低到+2价;氯元素化合价从-1价升高为0价;双线桥表示为: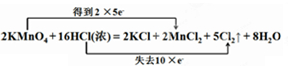 ;
;
故答案为:
②2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,化学腐蚀分析可知,氧化剂高锰酸钾2mol,氧化还原剂HCl10mol,则氧化剂和还原剂的物质的量之比为1:5;
故答案为:1:5;
③依据化学方程式可知每转移10mol电子,被氧化的HCl为10mol,当有0.2mole-转移时被氧化的HCl的物质的量为0.2mol,质量=0.2mol×36.5g/mol=7.3g;反应中氯化氢中元素化合价变化的被氧化,元素化合价不变的未被氧化,所以该反应中被氧化和未被氧化的盐酸的物质的量之比=10:6=5:3;
故答案为:7.3g,5:3;
④将20ml 12mol?L-1的浓盐酸溶液中含有0.24mol,与足量KMnO4充分反应理论上生成氯气物质的量0.075mol,标准状况下体积=0.075mol×22.4L/mol=1.68L;反应过程中浓盐酸易挥发出氯化氢混在氯气中,装置中的氯气不能被全部赶出,导致收集气体减少,所以实际收集到的氯气体积在标准状况下小于1.68L;
故答案为:D;
故答案为:ECDABHGF;
(2)饱和食盐水是用来除去氯气中的氯化氢气体,降低氯气的溶解度;氯气有毒用氢氧化钠溶液吸收,氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水;
故答案为:除去挥发出的氯化氢气体,抑制氯气在水中的溶解度;吸收过量的氯气;
(3)氯气具有氧化性遇到淀粉碘化钾溶液会氧化碘离子为单质碘遇淀粉变蓝,反应的化学方程式为:2KI+Cl2=2KCl+I2;
故答案为:试纸变蓝,2KI+Cl2=2KCl+I2 ;
(4)①气体发生装置是二氧化锰和浓盐酸加热反应生成氯气的反应,反应的化学方程式为:MnO2+4HCl
| ||
故答案为:MnO2+4HCl
| ||
②氯气有毒用氢氧化钠溶液吸收,氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O;
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(5)①依据元素化合价变化升降数值,结合氧化还原反应的双线桥标出电子转移方向和数目;锰元素化合价从+7价降低到+2价;氯元素化合价从-1价升高为0价;双线桥表示为:
 ;
;故答案为:

②2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,化学腐蚀分析可知,氧化剂高锰酸钾2mol,氧化还原剂HCl10mol,则氧化剂和还原剂的物质的量之比为1:5;
故答案为:1:5;
③依据化学方程式可知每转移10mol电子,被氧化的HCl为10mol,当有0.2mole-转移时被氧化的HCl的物质的量为0.2mol,质量=0.2mol×36.5g/mol=7.3g;反应中氯化氢中元素化合价变化的被氧化,元素化合价不变的未被氧化,所以该反应中被氧化和未被氧化的盐酸的物质的量之比=10:6=5:3;
故答案为:7.3g,5:3;
④将20ml 12mol?L-1的浓盐酸溶液中含有0.24mol,与足量KMnO4充分反应理论上生成氯气物质的量0.075mol,标准状况下体积=0.075mol×22.4L/mol=1.68L;反应过程中浓盐酸易挥发出氯化氢混在氯气中,装置中的氯气不能被全部赶出,导致收集气体减少,所以实际收集到的氯气体积在标准状况下小于1.68L;
故答案为:D;
点评:本题考查实验室制备干燥纯净的氯气的实验步骤和试剂选择,氧化还原反应电子转移的标注和计算,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目


 MnCl2+Cl2+2H2O
MnCl2+Cl2+2H2O
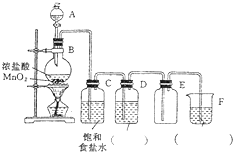 在实验室中用二氧化锰和浓盐酸反应制备干燥的氯气,装置图如图:
在实验室中用二氧化锰和浓盐酸反应制备干燥的氯气,装置图如图: