摘要:量变化如图所示.根据题完成下列各问: ①反应达到平衡时.平衡常数K= . 此时增加N2的量.平衡常数将 . ②反应进行到20min时.N2的平均反应速率为 . ③据图判断.反应进行到10min至20min时曲线发生变化的原因是 ,反应进行至25min时.曲线发生变化的原顺是 . 条件下.向容器中通入a molN2与b molH2的混合气体.当反应达到平衡时.测得n(N2)=c mol,n(NH3)=d mol,则a= (用含其它字母的关系式表示). ②若在上述相同温度和催化剂的条件下.向一个初始容积仍为1L的.但容积可变.能保持恒压的密闭容器中通入a mol N2与b mol H2的混合气体.反应达平衡时生成NH3 e mol.则d与e比较 A.d<e B.d>e C.d=e D.不能比较作出此判断的理由是 .
网址:http://m.1010jiajiao.com/timu_id_386576[举报]
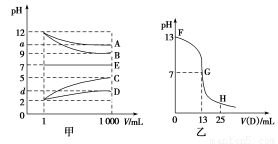
物质A~E都是由下表中的离子组成的,常温下将各物质的溶
液从1 mL稀释到1 000 mL,pH的变化关系如图甲所示,其中A与D反应得到E。请回答下列问题。
| 阳离子 | NH4+、H+、Na+ |
| 阴离子 | OH-、CH3COO-、Cl- |

(1)根据pH的变化关系,写出物质的化学式:B ,C 。
(2)写出A与C反应的离子方程式: 。
(3)图乙为室温时向25 mL某浓度的B溶液中逐滴滴加0.2 mol·L-1的D溶液的过程中pH的变化曲线。
①图乙中B的物质的量浓度为 mol·L-1。
②G点溶液呈中性,则二者恰好完全反应的点是在FG区间还是GH区间? 区间。
③FG区间溶液中各离子浓度大小关系是 。
(4)t ℃时,A的稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=13,该温度下(t ℃),将100 mL 0.2 mol·L-1的C溶液与100 mL 0.4 mol·L-1的B溶液混合后(溶液体积变化忽略不计),溶液的pH= 。 查看习题详情和答案>>
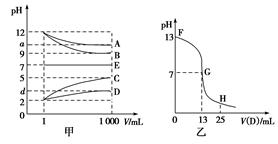
物质A~E都是由下表中的离子组成的,常温下将各物质的溶
液从1 mL稀释到1 000 mL,pH的变化关系如图甲所示,其中A与D反应得到E。请回答下列问题。
阳离子 | NH4+、H+、Na+ |
阴离子 | OH-、CH3COO-、Cl- |
(1)根据pH的变化关系,写出物质的化学式:B ,C 。
(2)写出A与C反应的离子方程式: 。
(3)图乙为室温时向25 mL某浓度的B溶液中逐滴滴加0.2 mol·L-1的D溶液的过程中pH的变化曲线。
①图乙中B的物质的量浓度为 mol·L-1。
②G点溶液呈中性,则二者恰好完全反应的点是在FG区间还是GH区间? 区间。
③FG区间溶液中各离子浓度大小关系是 。
(4)t ℃时,A的稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=13,该温度下(t ℃),将100 mL 0.2 mol·L-1的C溶液与100 mL 0.4 mol·L-1的B溶液混合后(溶液体积变化忽略不计),溶液的pH= 。
查看习题详情和答案>>
物质A~E都是由下表中的离子组成的,常温下将各物质的溶
液从1 mL稀释到1 000 mL,pH的变化关系如图甲所示,其中A与D反应得到E。请回答下列问题。
(1)根据pH的变化关系,写出物质的化学式:B ,C 。
(2)写出A与C反应的离子方程式: 。
(3)图乙为室温时向25 mL某浓度的B溶液中逐滴滴加0.2 mol·L-1的D溶液的过程中pH的变化曲线。
①图乙中B的物质的量浓度为 mol·L-1。
②G点溶液呈中性,则二者恰好完全反应的点是在FG区间还是GH区间? 区间。
③FG区间溶液中各离子浓度大小关系是 。
(4)t ℃时,A的稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=13,该温度下(t ℃),将100 mL 0.2 mol·L-1的C溶液与100 mL 0.4 mol·L-1的B溶液混合后(溶液体积变化忽略不计),溶液的pH= 。
液从1 mL稀释到1 000 mL,pH的变化关系如图甲所示,其中A与D反应得到E。请回答下列问题。
| 阳离子 | NH4+、H+、Na+ |
| 阴离子 | OH-、CH3COO-、Cl- |

(1)根据pH的变化关系,写出物质的化学式:B ,C 。
(2)写出A与C反应的离子方程式: 。
(3)图乙为室温时向25 mL某浓度的B溶液中逐滴滴加0.2 mol·L-1的D溶液的过程中pH的变化曲线。
①图乙中B的物质的量浓度为 mol·L-1。
②G点溶液呈中性,则二者恰好完全反应的点是在FG区间还是GH区间? 区间。
③FG区间溶液中各离子浓度大小关系是 。
(4)t ℃时,A的稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=13,该温度下(t ℃),将100 mL 0.2 mol·L-1的C溶液与100 mL 0.4 mol·L-1的B溶液混合后(溶液体积变化忽略不计),溶液的pH= 。
Ⅰ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答:
(1)在一定体积的恒容密闭容器中,进行如下化学反应: N2(g)+3H2(g) 2NH3(g) 其化学平衡常数K与温度t的关系如下表,根据下表完成下列问题
2NH3(g) 其化学平衡常数K与温度t的关系如下表,根据下表完成下列问题
(1)在一定体积的恒容密闭容器中,进行如下化学反应: N2(g)+3H2(g)
 2NH3(g) 其化学平衡常数K与温度t的关系如下表,根据下表完成下列问题
2NH3(g) 其化学平衡常数K与温度t的关系如下表,根据下表完成下列问题 
①比较K1、K2的大小:K1_______K2(填“>”、“=”或“<”)
②判断该反应达到化学平衡状态的依据是____________(填序号)。
A.2v(H2)(正)=3v(NH3)(逆)
B.v(N2)(正)=3v(H2)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
(2)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出盐酸肼第一步水解反应的离子方程式____________________。
②盐酸肼水溶液中离子浓度的排列顺序正确的是______________(填序号)。
A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-);
B.c(Cl-)>c([N2H5·H2O+])> c(H+)>c(OH-);
C.c(N2H62+)+ c([N2H5·H2O+])+c(H+)= c(Cl-)+c(OH-);
D.c(N2H62+)> c(Cl-)>c(H+)>c(OH-);
Ⅱ.水体中重金属铅的污染问题备受关注。查资料得知Pb4+具有很强的氧化性。水中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2(在水中溶解度小)、Pb(OH)3-、Pb(OH)42-,各形态的物质的量的分数α随溶液pH变化的关系如下图所示:
②判断该反应达到化学平衡状态的依据是____________(填序号)。
A.2v(H2)(正)=3v(NH3)(逆)
B.v(N2)(正)=3v(H2)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
(2)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出盐酸肼第一步水解反应的离子方程式____________________。
②盐酸肼水溶液中离子浓度的排列顺序正确的是______________(填序号)。
A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-);
B.c(Cl-)>c([N2H5·H2O+])> c(H+)>c(OH-);
C.c(N2H62+)+ c([N2H5·H2O+])+c(H+)= c(Cl-)+c(OH-);
D.c(N2H62+)> c(Cl-)>c(H+)>c(OH-);
Ⅱ.水体中重金属铅的污染问题备受关注。查资料得知Pb4+具有很强的氧化性。水中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2(在水中溶解度小)、Pb(OH)3-、Pb(OH)42-,各形态的物质的量的分数α随溶液pH变化的关系如下图所示:
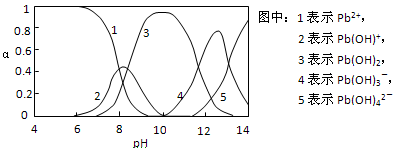
(1)Pb(NO3)2溶液中,c(Pb2+)/c(NO3-)_________1/2(填“>”、“=”、“<”)
(2)向Pb(NO3)2溶液滴加盐酸,溶液中c(Pb2+)/c(NO3-)没有变大,反而变小并有沉淀生成,则生成的沉淀可能为___________。
(3)向Pb(NO3)2溶液中滴加NaOH溶液,溶液也变浑浊,在pH约为________时生成沉淀最多,继续滴加NaOH溶液,混合体系又逐渐变澄清。pH = 13时,混合体系中发生的主要反应的离子方程式为:_____________________。
查看习题详情和答案>>
(2)向Pb(NO3)2溶液滴加盐酸,溶液中c(Pb2+)/c(NO3-)没有变大,反而变小并有沉淀生成,则生成的沉淀可能为___________。
(3)向Pb(NO3)2溶液中滴加NaOH溶液,溶液也变浑浊,在pH约为________时生成沉淀最多,继续滴加NaOH溶液,混合体系又逐渐变澄清。pH = 13时,混合体系中发生的主要反应的离子方程式为:_____________________。
20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态.分析图中信息,回答下列问题:
(1)图一是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
(2)图二是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程与能量关系图(图中 的△H表示生成1mol产物的数据).根据图二回答下列问题:
①P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式
②P(s)和Cl2(g)分两步反应生成1molPCl5(g)的△H1与P(s)和Cl2(g)一步反应生成1molPCl5(g)的△H2关系是:△H2
查看习题详情和答案>>
(1)图一是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ/mol
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ/mol
.在反应体系中加入催化剂,E1和E2的变化是:E1减小
减小
,E2减小
减小
(填“增大”、“减小”或“不变”),对反应热是否有影响?无影响
无影响
,原因是催化剂只降低反应所需的活化能,不能改变反应物的总能量和生成物总能量之差,即反应热不变
催化剂只降低反应所需的活化能,不能改变反应物的总能量和生成物总能量之差,即反应热不变
.(2)图二是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程与能量关系图(图中 的△H表示生成1mol产物的数据).根据图二回答下列问题:
①P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式
P(s)+Cl2(g)═PCl3(g)△H=-306KJ/mol
P(s)+Cl2(g)═PCl3(g)△H=-306KJ/mol
.②P(s)和Cl2(g)分两步反应生成1molPCl5(g)的△H1与P(s)和Cl2(g)一步反应生成1molPCl5(g)的△H2关系是:△H2
等于
等于
△H1(填“大于”、“小于”或“等于”),原因是根据盖斯定律可知,如果一个化学反应可以分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的
根据盖斯定律可知,如果一个化学反应可以分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的
.