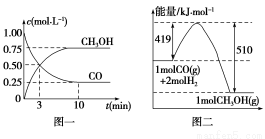
题目内容
物质A~E都是由下表中的离子组成的,常温下将各物质的溶
液从1 mL稀释到1 000 mL,pH的变化关系如图甲所示,其中A与D反应得到E。请回答下列问题。
阳离子 | NH4+、H+、Na+ |
阴离子 | OH-、CH3COO-、Cl- |
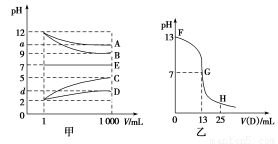
(1)根据pH的变化关系,写出物质的化学式:B ,C 。
(2)写出A与C反应的离子方程式: 。
(3)图乙为室温时向25 mL某浓度的B溶液中逐滴滴加0.2 mol·L-1的D溶液的过程中pH的变化曲线。
①图乙中B的物质的量浓度为 mol·L-1。
②G点溶液呈中性,则二者恰好完全反应的点是在FG区间还是GH区间? 区间。
③FG区间溶液中各离子浓度大小关系是 。
(4)t ℃时,A的稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=13,该温度下(t ℃),将100 mL 0.2 mol·L-1的C溶液与100 mL 0.4 mol·L-1的B溶液混合后(溶液体积变化忽略不计),溶液的pH= 。
(1)NaOH HCl
(2)NH3·H2O+H+=NH4++H2O
(3)①0.1 ②FG
③c(Na+)>c(OH-)≥c(CH3COO-)>c(H+)或c(Na+)>c(CH3COO-)≥c(OH-)>c(H+)
(4)12
【解析】根据各物质的溶液从1 mL稀释到1 000 mL,pH的变化图象知,B和C溶液的pH变化为3,A和D溶液的pH变化小于3,则B为强碱,A为弱碱或强碱弱酸盐,C为强酸,D为弱酸或强酸弱碱盐,可先确定B为NaOH,C为HCl。结合A与D反应得到E,而E的pH不变,则E可能是NaCl或醋酸铵,结合B为NaOH,C为HCl,则推出E只能为醋酸铵,所以A为NH3·H2O,B为NaOH,C为HCl,D为CH3COOH。向NaOH溶液中滴加醋酸,起点pH=13,NaOH的浓度为0.1 mol·L-1。二者恰好完全反应生成醋酸钠,此时溶液显碱性,应该在FG区间。FG区间溶液呈碱性,c(OH-)>c(H+),所以c(Na+)>c(CH3COO-),c(CH3COO-)和c(OH-)的大小关系无法判断。根据t ℃时,稀氨水中c(H+)和c(OH-)的值可知该温度下水的离子积常数KW为10-13,所以将100 mL 0.2 mol·L-1的HCl溶液与100 mL 0.4 mol·L-1的NaOH溶液混合后,溶液呈碱性,c(OH-)=(100×0.4-100×0.2)/200(mol·L-1)=0.1 mol·L-1,c(H+)=KW/c(OH-)=10-12 mol·L-1,即pH=12。

某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是
Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+)。
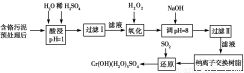
氢氧化物 | Fe(OH)3 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 11.1 | 8 | 9(>9溶液) |
部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见上表。
(1)酸浸时,为了提高浸取率可采取的措施为________________(至少写一条)。
(2)调pH=8是为了除去________(填Fe3+、Al3+、Ca2+、Mg2+,下同)。
(3)钠离子交换树脂的原理为Mn++nNaR―→MRn+nNa+,被交换的杂质离子是________。
(4)试配平反应方程式:
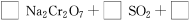
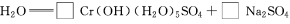 ;
;
生成1 mol Cr(OH)(H2O)5SO4消耗SO2的物质的量为________。
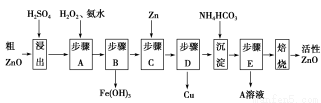
活性ZnO在橡胶、塑料、涂料工业中有重要应用,一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如下(已知:碱式碳酸锌经焙烧可制得活性ZnO):
已知:几种离子生成氢氧化物沉淀时的pH如表:
待沉淀离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
请回答下列问题:
(1)步骤A加H2O2发生反应的离子方程式是 ,该步骤需控制溶液pH的范围是 。
(2)A溶液中主要含有的溶质是 。
(3)碱式碳酸锌经焙烧制得活性ZnO的反应ΔH>0,该反应能自发进行的原因是ΔS (选填“=”、“>”或“<”)0。
(4)若经处理后的废水pH=8,此时Zn2+的浓度为 mg/L(常温下,Ksp[Zn(OH)2]=1.2×10-17)。