题目内容
20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态.分析图中信息,回答下列问题:
(1)图一是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
(2)图二是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程与能量关系图(图中 的△H表示生成1mol产物的数据).根据图二回答下列问题:
①P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式
②P(s)和Cl2(g)分两步反应生成1molPCl5(g)的△H1与P(s)和Cl2(g)一步反应生成1molPCl5(g)的△H2关系是:△H2
(1)图一是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ/mol
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ/mol
.在反应体系中加入催化剂,E1和E2的变化是:E1减小
减小
,E2减小
减小
(填“增大”、“减小”或“不变”),对反应热是否有影响?无影响
无影响
,原因是催化剂只降低反应所需的活化能,不能改变反应物的总能量和生成物总能量之差,即反应热不变
催化剂只降低反应所需的活化能,不能改变反应物的总能量和生成物总能量之差,即反应热不变
.(2)图二是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程与能量关系图(图中 的△H表示生成1mol产物的数据).根据图二回答下列问题:
①P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式
P(s)+Cl2(g)═PCl3(g)△H=-306KJ/mol
P(s)+Cl2(g)═PCl3(g)△H=-306KJ/mol
.②P(s)和Cl2(g)分两步反应生成1molPCl5(g)的△H1与P(s)和Cl2(g)一步反应生成1molPCl5(g)的△H2关系是:△H2
等于
等于
△H1(填“大于”、“小于”或“等于”),原因是根据盖斯定律可知,如果一个化学反应可以分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的
根据盖斯定律可知,如果一个化学反应可以分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的
.
分析:(1)由图一可知,NO2和CO得总能量大于生成物CO2和NO得总能量,该反应为放热反应,当加入催化剂,改变反应的途径,降低反应所需的活化能,则E1和E2都减小,但它们的差△H不变;
(2)①由图二可知,P(s)和Cl2(g)反应生成PCl3(g)放出热量,PCl5(g)分解成PCl3(g)和Cl2(g)吸收热量,以此来书写热化学方程式;
②根据盖斯定律来分析反应得关系及能量关系.
(2)①由图二可知,P(s)和Cl2(g)反应生成PCl3(g)放出热量,PCl5(g)分解成PCl3(g)和Cl2(g)吸收热量,以此来书写热化学方程式;
②根据盖斯定律来分析反应得关系及能量关系.
解答:解:(1)NO2和CO反应生成CO2和NO,化学方程式为NO2+CO═CO2+NO,
由图一可知,△H=E1-E2=134KJ/mol-368KJ/mol=-234KJ/mol,
则热化学方程式为NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234KJ/mol,
当加入催化剂,改变反应的途径,降低反应所需的活化能,则E1和E2都减小,但E1和E2的差△H不变,
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ/mol;减小;减小;无影响;催化剂只降低反应所需的活化能,不能改变反应物的总能量和生成物总能量之差,即反应热不变;
(2)①由图二可知,P(s)和Cl2(g)反应生成PCl3(g)放出热量为306KJ,则热化学方程式为P(s)+Cl2(g)═PCl3(g)△H=-306KJ/mol,
故答案为:P(s)+Cl2(g)═PCl3(g)△H=-306KJ/mol;
②由盖斯定律可知,一个化学反应无论一步完成还是分步完成,其热效应相同,
即反应中的能量变化只与起态、终态有关,与反应的途径无关,
则P(s)和Cl2(g)分两步反应生成1molPCl5(g)的△H1与P(s)和Cl2(g)一步反应生成1molPCl5(g)的△H2相等,
故答案为:等于;根据盖斯定律可知,反应中的能量变化只与起态、终态有关,与反应的途径无关.
由图一可知,△H=E1-E2=134KJ/mol-368KJ/mol=-234KJ/mol,
则热化学方程式为NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234KJ/mol,
当加入催化剂,改变反应的途径,降低反应所需的活化能,则E1和E2都减小,但E1和E2的差△H不变,
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ/mol;减小;减小;无影响;催化剂只降低反应所需的活化能,不能改变反应物的总能量和生成物总能量之差,即反应热不变;
(2)①由图二可知,P(s)和Cl2(g)反应生成PCl3(g)放出热量为306KJ,则热化学方程式为P(s)+Cl2(g)═PCl3(g)△H=-306KJ/mol,
故答案为:P(s)+Cl2(g)═PCl3(g)△H=-306KJ/mol;
②由盖斯定律可知,一个化学反应无论一步完成还是分步完成,其热效应相同,
即反应中的能量变化只与起态、终态有关,与反应的途径无关,
则P(s)和Cl2(g)分两步反应生成1molPCl5(g)的△H1与P(s)和Cl2(g)一步反应生成1molPCl5(g)的△H2相等,
故答案为:等于;根据盖斯定律可知,反应中的能量变化只与起态、终态有关,与反应的途径无关.
点评:本题考查热化学反应方程式及能量变化图象,明确图象中E的含义、热化学方程式书写的方法即可解答,难度不大.

练习册系列答案
相关题目
(8分)(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是 (填“吸热”或“放热”)反应,NO2和CO的总能量 (填“>”、“<”或“=”)CO2和NO的总能量。
(2)在某体积为2L的密闭容器中充入0.5mol NO2和1mol CO,在一定条件下发生反应:NO2+CO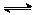 CO2+NO,2 min时,测得容器中NO的物质的量为0.2 mol ,则:
CO2+NO,2 min时,测得容器中NO的物质的量为0.2 mol ,则:
①该段时间内,用CO2表示的平均反应速率为 。
②假设此反应在5 min时达到平衡,则此时容器内气体的总物质的量为 。
③下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是
| A.容器内气体的质量保持变 | B.NO2的物质的量浓度不再改变 |
| C.容器内气体的平均相对分子质量不变 | D.NO2的消耗速率与CO2的消耗速率相等 |
 (1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是
(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是 CO2+NO,2min时,测得容器中NO的物质的量为0.2mol,则:
CO2+NO,2min时,测得容器中NO的物质的量为0.2mol,则:
 CO2+NO,2 min时,测得容器中NO的物质的量为0.2 mol ,则:
CO2+NO,2 min时,测得容器中NO的物质的量为0.2 mol ,则:
 CO2+NO,2 min时,测得容器中NO的物质的量为0.2 mol ,则:
CO2+NO,2 min时,测得容器中NO的物质的量为0.2 mol ,则: